Вариант 15
1. Идеальный газ, состоящий из N одинаковых атомов заключен в обьеме V и находится в термостате с температурой T. Исходя из канонического распределения Гиббса, найдите термическое и калорическое уравнения состояния газа.
2. Рассчитайте мольные энтропию, внутреннюю энергию, энтальпию, свободные энергии Гельмгольца и Гиббса газообразного неона при T = 298 K и давлении 1 атм.
3. Рассчитайте значение константы равновесия Kp для газофазной реакции:
D2 + H2 = 2DH
при 298 К. Примите, что равновесные расстояния и
силовые постоянные молекул H2 и D2
одинаковы. Для молекулы Н2 равновесное
расстояние между атомами водорода равно 0.7416 A, а
колебательное волновое число составляет 4395.24 см-1,
энергия диссоциации ![]() =
4.476 эВ. Дополнительные необходимые силовые
постоянные оцените по соотношению 2pn = (k/
=
4.476 эВ. Дополнительные необходимые силовые
постоянные оцените по соотношению 2pn = (k/![]() )1/2, где
)1/2, где ![]() - приведенная масса, а разность
энергий при 0 К - по уравнению:
- приведенная масса, а разность
энергий при 0 К - по уравнению:
DU0 = 1/2NA h (2![]() HD -
HD - ![]() H2 -
H2 - ![]() D2 ). (ответ)
D2 ). (ответ)
Вариант 16
1. Молекула ацетилена HCCH линейная, имеет три
валентных и четыре деформационных колебания.
Наблюдаемая изохорная теплоемкость CV =
66.51 Дж/(КЧ моль). Определите CV для
ацетилена а) из приложения классической механики
к движению ядер; б) в предположении, что валентные
колебания имеют очень высокую частоту (h![]() /кТ >> 1), а
деформационные колебания - очень низкую (h
/кТ >> 1), а
деформационные колебания - очень низкую (h![]() /кТ << 1); в) предполагая,
что все колебания имеют очень высокую частоту.
Обьясните связь между этими предположениями и
экспериментальным значением изохорной
теплоемкости.
/кТ << 1); в) предполагая,
что все колебания имеют очень высокую частоту.
Обьясните связь между этими предположениями и
экспериментальным значением изохорной
теплоемкости.
2. Рассчитайте мольные энтропию, внутреннюю энергию, энтальпию, свободные энергии Гельмгольца и Гиббса, изобарную теплоемкость газообразного аргона при T = 298 K и давлении 1 атм, если основное электронное состояние аргона невырождено.
3. Постройте термодинамику однокомпонентного одноатомного идеального газа Больцмана, исходя из большого канонического распределения Гиббса. Найдите термическое и калорическое уравнения состояния и химический потенциал.
(ответ)
Вариант 17
1. Пусть для некоторой гипотетической молекулы
молекулярная сумма по состояниям равна: q = 2 + ![]() /(kT). Найдите выражения
для: а) мольной средней энергии; б) мольной
энтропии; в) мольной изохорной теплоемкости.
/(kT). Найдите выражения
для: а) мольной средней энергии; б) мольной
энтропии; в) мольной изохорной теплоемкости.
2. Пользуясь большим каноническим
распределением Гиббса, найдите вероятность
события, состоящего в том, что в открытой
однокомпонентной системе содержится N
частиц. Получите выражение для среднего числа
частиц в системе <N>, среднего квадрата
числа частиц в системе <N2> и среднего
квадрата флюктуаций числа частиц в системе <![]() N2>.
N2>.
3. Рассчитайте значения стандартных
термодинамических функций (![]() G,
G, ![]() H,
H, ![]() S) и константы
равновесия газофазной реакции образования
молекулы хлора из атомов
S) и константы
равновесия газофазной реакции образования
молекулы хлора из атомов
Cl + Cl = Cl2
как функции температуры, и значения этих величин при T = 298 K.(ответ)
Вариант 18
1. Пусть некоторая молекула существует в трех
состояниях с энергиями, равными 0, ![]() и
и ![]() . Найдите
выражение для молекулярной суммы по состояниям Q
и выражения для мольных внутренней энергии и
изохорной теплоемкости.
. Найдите
выражение для молекулярной суммы по состояниям Q
и выражения для мольных внутренней энергии и
изохорной теплоемкости.
2. Рассчитайте мольные энтропию, внутреннюю энергию, энтальпию, свободные энергии Гельмгольца и Гиббса атомарного газообразного углерода при T = 298K и давлении 1 атм.
3. Рассчитайте значения стандартных
термодинамических функций (![]() G,
G, ![]() H,
H, ![]() S) и константы
равновесия газофазной реакции образования
молекулы фтористого водорода из атомов
S) и константы
равновесия газофазной реакции образования
молекулы фтористого водорода из атомов
F + H = HF
как функции температуры, и значения этих величин при T = 298 K. Используя полученный результат, найдите соответствующие величины для реакции образования фтористого водорода из молекул фтора и водорода.(ответ)
Вариант 19
1. Определите дисперсию координаты и импульса конечной точки покоящейся пружины, подчиняющейся закону Гука, а также ее среднюю кинетическую, потенциальную и полную энергию.
2. Для некоторых молекул, в частности, для
кислорода и окиси азота, дополнительный вклад в
термодинамические свойства дают два электронных
уровня, расстояние между которыми ![]() мало по сравнению с kT. Вычислите
статистическую сумму для подобной двухуровневой
системы и покажите, что электронный вклад в
теплоемкость задается соотношением
мало по сравнению с kT. Вычислите
статистическую сумму для подобной двухуровневой
системы и покажите, что электронный вклад в
теплоемкость задается соотношением
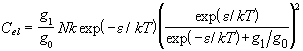
где g0 и g1 - вырожденности основного и возбужденного электронных состояний, соответственно. Исследуйте высокотемпературный и низкотемпературный пределы электронной теплоемкости, и найдите условие экстремума Cel.
3. Рассчитайте мольные энтропию, внутреннюю
энергию, энтальпию, свободные энергии
Гельмгольца и Гиббса газообразного
молекулярного хлора при T = 298K и давлении 1 атм,
если межядерное расстояние равно 1.988*10-10 м,
волновое колебательное число ![]() = 0.5649*105 м-1,
а основное электронное состояние является
невырожденным.(ответ)
= 0.5649*105 м-1,
а основное электронное состояние является
невырожденным.(ответ)