|
Учебные материалы по физической химии
Задачи по физической химии.Часть 2.Химическая кинетика. Электрохимия
Глава 2. Электрохимия
10. Электропроводность растворов
электролитов
Электропроводность  ("Каппа") раствора -
величина, обратная его сопротивлению R, имеет
размерность Ом-1. Для проводника
постоянного сечения ("Каппа") раствора -
величина, обратная его сопротивлению R, имеет
размерность Ом-1. Для проводника
постоянного сечения
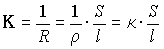 , ,
где  - удельное
сопротивление; S - площадь сечения проводника;
l - длина проводника; - удельное
сопротивление; S - площадь сечения проводника;
l - длина проводника;  - удельная электропроводность.
- удельная электропроводность.
Удельной электропроводностью  ("каппа") раствора называется
электропроводность слоя раствора длиной 1 см,
заключенного между электродами площадью 1см2.
Она выражается в Ом-1. см-1. В системе
СИ удельная электропроводность измеряется в Ом-1.
м-1. ("каппа") раствора называется
электропроводность слоя раствора длиной 1 см,
заключенного между электродами площадью 1см2.
Она выражается в Ом-1. см-1. В системе
СИ удельная электропроводность измеряется в Ом-1.
м-1.
Эквивалентной электропроводностью  ("лямбда") называется
электропроводность такого объема раствора, в
котором содержится 1 г-экв растворенного
вещества; при условии, что электроды находятся на
расстоянии 1 см друг от друга, она выражается в Ом-1.
см2. г-экв-1. ("лямбда") называется
электропроводность такого объема раствора, в
котором содержится 1 г-экв растворенного
вещества; при условии, что электроды находятся на
расстоянии 1 см друг от друга, она выражается в Ом-1.
см2. г-экв-1.
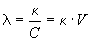 , ,
где V = 1/C - разведение (или разбавление)
раствора, т.е. объем, в котором содержится 1 г-экв
растворенного вещества, а C - эквивалентная
концентрация (нормальность) раствора. В системе
СИ эквивалентная электропроводность выражается
в Ом-1. м2. кг-кв-1.
Эквивалентная электропроводность  растворов электролитов
возрастает с ростом разбавления раствора и при
бесконечном разбавлении (т.е. при бесконечно
малой концентрации) достигает предельного
значения растворов электролитов
возрастает с ростом разбавления раствора и при
бесконечном разбавлении (т.е. при бесконечно
малой концентрации) достигает предельного
значения  0.
которое называется эквивалентной
электропроводностью раствора при бесконечном
разведении. 0.
которое называется эквивалентной
электропроводностью раствора при бесконечном
разведении.
В разбавленных растворах сильных электролитов
выполняется эмпирический закон Кольрауша
(закон квадратного корня):
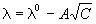 , ,
где  и и  0 - эквивалентная
электропроводность раствора при концентрации С
и при бесконечном разведении, A - константа
(при данной температуре) для данного электролита
и растворителя. 0 - эквивалентная
электропроводность раствора при концентрации С
и при бесконечном разведении, A - константа
(при данной температуре) для данного электролита
и растворителя.
В растворах слабых электролитов  и и  0
связаны со степенью диссоциации 0
связаны со степенью диссоциации  электролита уравнением Аррениуса: электролита уравнением Аррениуса:
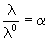 . .
Кроме того, выполняется закон разведения
Оствальда, который для бинарного электролита
записывается следующим образом:
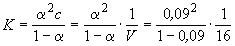 , ,
где K - константа диссоциации слабого
электролита.
Электропроводность электролитов связана со
скоростями движения ионов в растворе. Скорость
движения vi [м.с-1] иона в
растворе пропорциональна напряженности
приложенного электрического поля E [В.м-1]:
vi = uiE.
Коэффициент пропорциональности u [м2. с-1.
В-1] называется абсолютной подвижностью
иона.
Произведение uiF (F - постоянная
Фарадея) называется подвижностью иона  i[Ом-1. м2.
кг-экв-1]: i[Ом-1. м2.
кг-экв-1]:
 i = uiF. i = uiF.
Подвижность иона при бесконечном разбавлении
называется предельной подвижностью иона
и обозначается  i0.
Предельные подвижности i0.
Предельные подвижности  i0 некоторых ионов в водном
растворе [Ом-1. см2. г-экв-1]
приведены в Таблице 10.1.
i0 некоторых ионов в водном
растворе [Ом-1. см2. г-экв-1]
приведены в Таблице 10.1.
Согласно закону Кольрауша о
независимой миграции ионов, эквивалентная
электропроводность раствора при бесконечном
разведении равна сумме предельных подвижностей
катионов и анионов:
 0 = 0 =  0+ + 0+ +  0-. 0-.
Доля тока, переносимая данным ионом, называется
числом переноса ti иона:
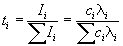 , ,
причем по определению 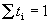 . .
Согласно закону Стокса, предельная
подвижность  0
иона с зарядом z и радиусом r в
растворителе с вязкостью h описывается формулой: 0
иона с зарядом z и радиусом r в
растворителе с вязкостью h описывается формулой:
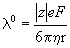 , ,
где e - элементарный заряд, F - постоянная
Фарадея.
Таблица 10.1
Предельные подвижности  i0 некоторых ионов в
водном растворе при 25oC [Ом-1.см2.г-экв-1] i0 некоторых ионов в
водном растворе при 25oC [Ом-1.см2.г-экв-1]
Катионы |
 i0 i0
|
Анионы |
 i0 i0
|
| H+ |
349.8 |
OH- |
198.3 |
| Li+ |
36.68 |
F- |
55.4 |
| Na+ |
50.10 |
Cl- |
76.35 |
| K+ |
73.50 |
Br- |
78.14 |
| Rb+ |
77.81 |
I- |
78.84 |
| Ag+ |
61.90 |
ClO3- |
64.6 |
| NH4+ |
73.55 |
ClO4- |
67.36 |
| N(CH3)4+ |
44.92 |
BrO3- |
55.74 |
| 1/2 Mg2+ |
53.05 |
CN- |
78 |
| 1/2 Ca2+ |
59.50 |
NO3- |
71.46 |
| 1/2 Ba2+ |
63.63 |
CH3COO- |
40.90 |
| 1/2 Mg2+ |
56.6 |
C6H5COO- |
35.8 |
| 1/2 Cd2+ |
54 |
H2PO4- |
36 |
| 1/3 Al3+ |
63 |
1/2 SO42- |
80.02 |
| 1/3 La3+ |
69.7 |
1/2 S2O62- |
93 |
Из этого уравнения следует правило
Вальдена-Писаржевского, согласно которому для
любого иона или электролита:
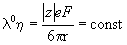 . .
ПРИМЕРЫ
Пример 10-1. Удельная электропроводность 0.135
моль.л-1 раствора пропионовой кислоты
C2H5COOH равна 4.79. 10-2 См.
м-1. Рассчитать эквивалентную
электропроводность раствора, константу
диссоциации кислоты и pH раствора, если
предельные подвижности H+ и C2H5COO-равны
349.8 См. см2. моль-1 и 37.2 См.см2 моль-1.
соответственно.
Решение.
 0 = 349.8 + 37.2 = 387.0
См.см2. моль-1. 0 = 349.8 + 37.2 = 387.0
См.см2. моль-1.
 = =  /C? 1000 = 4.79.10-2 См.м-1/0.135
моль.л-1. 1000 = 3.55 См. см2. моль-1. /C? 1000 = 4.79.10-2 См.м-1/0.135
моль.л-1. 1000 = 3.55 См. см2. моль-1.
 = =  / / 0 = 3.55/387.0 =
0.009. 0 = 3.55/387.0 =
0.009.
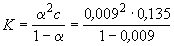 = 1.15.10-5
(моль. л-1). = 1.15.10-5
(моль. л-1).
[H+] =  . c =1.24.10-3(моль.л-1). . c =1.24.10-3(моль.л-1).
pH = -lg[H+] = 2.91.
Ответ.  = 3.55 См.см2.
моль-1; = 3.55 См.см2.
моль-1;  = 0.009; K
= 1.15.10-5 моль. л-1; pH = 2.91. = 0.009; K
= 1.15.10-5 моль. л-1; pH = 2.91.
Пример 10-2. Удельная электропроводность
насыщенного раствора BaCO3 в воде при 18oC
равна 25.475. 10-4 См. м-1.
Удельная электропроводность воды 4.5. 10-5
См. м-1. Подвижности ионов Ba2+ и CO32-
при 18oC равны соответственно 55 и 66 См.
см2. г-экв-1. Рассчитать растворимость
BaCO3 в воде при 18oC в моль. л-1.
считая соль полностью диссоциированной, а
подвижности ионов равными подвижностям при
бесконечном разведении.
Решение.
 (BaCO3) = (BaCO3) =  (р-ра) - (р-ра) -  (H2O) = 25.475. 10-4 - 4.5. 10-5
= 25.025. 10-4 См. м-1. (H2O) = 25.475. 10-4 - 4.5. 10-5
= 25.025. 10-4 См. м-1.
 0(BaCO3) = 0(BaCO3) =  0 (Ba2+) + 0 (Ba2+) +  0 (CO32-) = 0 (CO32-) =
= 55 + 66 = 121 См. см2. г-экв-1 = 1.21.
10-2 См. м2. г-экв-1.
С =  / / 0 = 0.206 г-экв. м-3 = 2.06.
10-4 г-экв. л-1 = 1.03. 10-4
моль. л-1. 0 = 0.206 г-экв. м-3 = 2.06.
10-4 г-экв. л-1 = 1.03. 10-4
моль. л-1.
Ответ. С = 1.03. 10-4 моль. л-1.
Пример 10-3. Удельная электропроводность 5%-го
раствора Mg(NO3)2 при 18oC равна 4.38
См. м-1. а его плотность - 1.038 г. см-3.
Рассчитать эквивалентную электропроводность
раствора и кажущуюся степень диссоциации соли в
растворе. Подвижности ионов Mg2+ и NO3-
при 18oC равны соответственно 44.6 и 62.6 См.
см2. г-экв-1.
Решение.
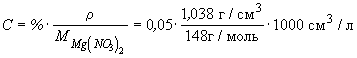 = 0.35 моль. л-1
= 0.70 г-экв. л-1. = 0.35 моль. л-1
= 0.70 г-экв. л-1.
 = = 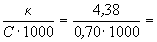 6.25. 10-3 См. м2. г-экв-1
= 62.5 (См. см2. г-экв-1). 6.25. 10-3 См. м2. г-экв-1
= 62.5 (См. см2. г-экв-1).
 0 = 44.6 + 62.6 = 107.2
(См. см2. г-экв-1). 0 = 44.6 + 62.6 = 107.2
(См. см2. г-экв-1).
 = =  / / 0 = 62.5/107.2 =
0.583. 0 = 62.5/107.2 =
0.583.
Ответ:  = 62.5 См.
см2. г-экв-1. = 62.5 См.
см2. г-экв-1.  =
0.583. =
0.583.
ЗАДАЧИ
10-1. Рассчитать удельную
электропроводность абсолютно чистой воды при 25oC.
Ионное произведение воды при 25oC равно 1.00.
10-14.(ответ)
10-2. Удельная электропроводность
бесконечно разбавленных растворов KCl, KNO3 и
AgNO3 при 25oC равна соответственно 149.9,
145.0 и 133.4 См. м2. моль-1. Какова
удельная электропроводность бесконечно
разбавленного раствора AgCl при 25oC? (ответ)
10-3. Удельная электропроводность
бесконечно разбавленных растворов соляной
кислоты, хлорида натрия и ацетата натрия при 25oC
равна соответственно 425.0. 128.1 и 91.0 См.м2 .моль-1.
Какова удельная электропроводность бесконечно
разбавленного раствора уксусной кислоты при 25oC?
(ответ)
10-4. Удельная электропроводность 4%
водного раствора H2SO4 при 18oC
равна 0.168 См. см-1. плотность раствора -
1.026 г.см-3. Рассчитать эквивалентную
электропроводность раствора. (ответ)
10-5. Удельная электропроводность
насыщенного раствора AgCl в воде при 25oC равна
2.28.10-4 См. м-1. а удельная
электропроводность воды 1.16.10-4 См.м-1.
Рассчитать растворимость AgCl в воде при 25oC в
моль. л-1. (ответ)
10-6. Какую долю общего тока переносит
ион Li+ в водном растворе LiBr при 25oC? (ответ)
10-7. Рассчитать число переноса H+
в растворе HCl с концентрацией 1.10-3
моль. л-1. Каково будет число переноса
H+, если к этому раствору добавить NaCl, чтобы
его концентрация была равна 1.0 моль. л-1?
(ответ)
10-8. Рассчитать скорость движения иона
Rb+ в водном растворе при 25oC, если
разность потенциалов 35 В приложена к электродам,
находящимся на расстоянии 0.8 см друг от друга. (ответ)
10-9. Рассчитать скорость движения иона
Na+ в водном растворе при 25oC, если
разность потенциалов 10 В приложена к электродам,
находящимся на расстоянии 1 см друг от друга.
Сколько времени понадобится иону, чтобы пройти
расстояние от одного электрода до другого?(ответ)
10-10. Удельная электропроводность
водного раствора KI равна 89.00 См. м-1. а
раствора KCl той же концентрации - 186.53 См. м-1.
Удельная электропроводность раствора,
содержащего обе соли, равна 98.45 См. м-1.
Рассчитать долю KCl в растворе. (ответ)
10-11. Удельная электропроводность
водного раствора сильного электролита при 25oC
равна 109.9 См. см2 .моль-1 при
концентрации 6.2.10-3 моль. л-1
и 106.1 См. см2 .моль-1 при
концентрации 1.5.10-2 моль.л-1.
Какова удельная электропроводность раствора при
бесконечном разбавлении? (ответ)
10-12. Рассчитать радиус иона N(CH3)4+
по закону Стокса из его предельной подвижности в
водном растворе при 25oC. Вязкость воды при 25oC
равна 8.91? 10-4 Па. с. Оценить предельную
подвижность этого иона в глицерине, вязкость
которого равна 1.49 Па. с. (ответ)
10-13. Оценить предельную подвижность
иона K+ в формамиде и метилацетате, если
вязкость формамида в 3.7 раз больше, а вязкость
метилацетата в 2.6 раз меньше, чем вязкость воды. (ответ)
10-14. Рассчитать удельную
электропроводность 1.0.10-3 M водного
раствора NaCl при 25oC, считая, что подвижности
ионов при этой концентрации равны их предельным
подвижностям. Через слой раствора длиной 1 см,
заключенный между электродами площадью 1 см2.
пропускают ток силой 1 мА. Какое расстояние
пройдут ионы Na+ и Cl- за 10 минут? (ответ)
10-15. Рассчитать эффективный радиус
иона Li+ при 25oC из его предельной
подвижности, используя закон Стокса. Рассчитать
приблизительное число молекул воды, входящих в
гидратную оболочку иона Li+.
Кристаллографический радиус иона Li+ равен
60 пм. Вязкость воды при 25oC равна 8.91.10-4
Па. с. Собственный объем молекулы воды
оценить из параметров уравнения Ван-дер-Ваальса. (ответ)
10-16. Константа диссоциации гидроксида
аммония равна 1.79.10-5 моль. л-1.
Рассчитать концентрацию NH4OH, при которой
степень диссоциации равна 0.01. и эквивалентную
электропроводность раствора при этой
концентрации. (ответ)
10-17. Эквивалентная электропроводность
1.59.10-4 моль. л-1 раствора
уксусной кислоты при 25oC равна 12.77 См.см2
.моль-1. Рассчитать константу
диссоциации кислоты и pH раствора. (ответ)
10-18. Константа диссоциации масляной
кислоты C3H7COOH равна 1.74. 10-5
моль.л-1. Эквивалентная
электропроводность раствора при разведении 1024 л.
моль-1 равна 41.3 См. см2 .моль-1.
Рассчитать степень диссоциации кислоты и
концентрацию ионов водорода в этом растворе, а
также эквивалентную электропроводность
раствора при бесконечном разведении. ( = 0.125; [H+] = 1.22.10-4
моль. л-1; = 0.125; [H+] = 1.22.10-4
моль. л-1;  0
= 330.7 См. см2 .моль-1.) (ответ) 0
= 330.7 См. см2 .моль-1.) (ответ)
10-19. Эквивалентная электропроводность
раствора гидроксида этиламмония C2H5NH3OH
при бесконечном разведении равна 232.6 См.см2
. моль-1. Рассчитать константу
диссоциации гидроксида этиламмония,
эквивалентную электропроводность раствора,
степень диссоциации и концентрацию ионов
гидроксила в растворе при разведении 16 л.моль-1.
если удельная электропроводность раствора при
данном разведении равна 1.312. 10-3 См.см-1.
(ответ)
|

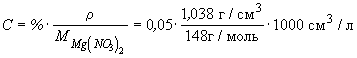 = 0.35 моль. л-1
= 0.70 г-экв. л-1.
= 0.35 моль. л-1
= 0.70 г-экв. л-1.