Оветы на задачи по физической химии. Часть 2.Химическая кинетика. Электрохимия
§ 1
1-1. w = –2 × d [N2]/dt = –2/3 × d[H2]/ dt .
1-2. Уменьшится в 2 раза.
1-3. а) 2; б) 3.
1-4. а) порядок реакции; б) скорость реакции, порядок реакции, константа скорости, стехиометрический коэффициент.
1-5. Очень редко и только для сложных реакций, например цепной реакции H2 + Br2 = 2HBr.
1-6. В 3 раза.
1-7. Третий.
1-8. k = 1.7 моль/(л × с × атм2), если скорость реакции выражена через концентрации; k = 40.9атм –1 ×
с–1 , если скорость реакции выражена через давление.
1-9. w = k × [A]n = k× {( nP – P0 )/[( n–1) RT]}n
, если n  1.
1.
1-10. б).
1-11. 2.46 × 10-9 моль/(л × с).
1-12. 4.5 × 10-5 л/(моль × с).
1-13. k = 2.0 × 10–4 л/(моль × с); w = 8.0 × 10–6 моль/(л × с).
1-14. В 6.0 раз.
1-15. [A] 0 / [B] 0 = 2:1.
§ 2
2-1. t x = –ln(1– x ) / k .
2-2. 90.4 мин.
2-3. 197.3 года
2-4. а) 0.64 мг; б) 0.18 мг.
2-5. 14.6%.
2-6. t 1/2 = 5.7 ч. а) P = 500.3 мм рт. ст.; б) P = 515 мм рт. ст.
2-7. Координаты точки пересечения: (1/ k ,0).
2-8. p = p 0 × [2–exp(– kt )]. t = ln2 / k . Степень протекания — 50%.
2-9. p = p 0 /2 × {1 + 1/[1+( p 0 kt / RT )]}. t = 2 RT / ( p 0 k ). Степень протекания — 2/3.
2-10. а) 0; б) 25%; в) 33.3%; г) 37.8%.
2-11. Реакция первого порядка.
2-12. 26.3 мин.
2-13. 2.57 × 10 –4 с.
2-14. 225 с.
2-15. 7.4 мин.
2-16. k = 0.248 л/(моль × мин). t 1/2 (A) = 42.8 мин; t 1/2 (B) = 123 мин.
*2-17. 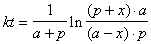 ,
, 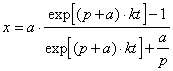 .
.
*2-18. 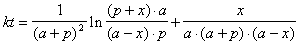 . Максимум скорости достигается, когда [A] = 2[P], т.е. a – x = 2( p + x ):
. Максимум скорости достигается, когда [A] = 2[P], т.е. a – x = 2( p + x ): 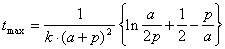
*2-19. 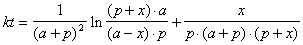 . Максимум скорости достигается, когда 2[A] = [P], т.е. p + x = 2( a – x ):
. Максимум скорости достигается, когда 2[A] = [P], т.е. p + x = 2( a – x ): 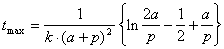 .
.
§ 3
3-1. Второй порядок, k = 0.039 л/(моль × с).
3-2. n = 2.
3-3. Два.
3-4. w = k × [A] × [B] 2 , k = 0.025 л/(моль × с).
3-5. Второй порядок по A, первый — по В.
3-6. Первый порядок. k = 0,0674 мин –1 .
3-7. Первый порядок. k = 8 ,83 с –1 .
3-8. Первый порядок. k = 0 ,35 мин –1 . t 1/2 = 1.98 мин.
3-9. Первый порядок. k = 0 ,0337 мин –1 .
3-10. k = 2.42 × 10 7 л/(моль × с).
3-11. Второй порядок. k = 0.0592 л/(моль × мин). m (NH 4 CNO) = 2.94 г.
3-12. 1.5.
§ 4
4-1. 39 о С.
4-2. 1.9.
4-3. а) 84.9 кДж/моль; б) 922 кДж/моль.
4-4. а) 349.3 К; б) 269.4 К.
4-5. В первом случае.
4-6. В a 1.5 раз.
4-7. E = E 1 + E 2 – E 3 ; A = A 1 ×
A 2 / A 3 .
4-8. k 1 = 4.58 × 10 –2 мин –1 , k 2 = 1.67 × 10 –1 мин –1 ; E A = 89.2 кДж/моль.
4-9. 37.6 о С.
4-10. 17 о С.
4-11. A = 8.0 × 10 –10 с –1 .
4-12. E A = 214 кДж/моль, k = 0.165 л/(моль × мин).
4-13. E A = 265.5 кДж/моль, k = 52.8 л/(моль × мин).
4-14. E A = 149.8 кДж/моль, k = 3.55 × 10 –6 с -1 .
4-15. E A = 47.1 кДж/моль, k = 79.0 л/(моль × мин).
4-16. E A = 104 кДж/моль, k = 5.71 л/(моль × мин).
4-17. E 2 – E 1 = 113 кДж/моль.
4-18. 306 К.
4-19. E A = 96.9 кДж/моль, A = 8.79 × 10 13 с –1 , t 1/2 = 770 с.
§ 5
5-2. t 1/2 = 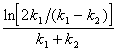 .
.
5-3. t 1/3 = 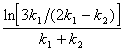 . ( k 2 ) min = 2 k 1 .
. ( k 2 ) min = 2 k 1 .
5-4. 3.6 с.
5-5. k 1 = 3.14 × 10 –3 мин –1 , k 2 = 1.04 × 10 –2 мин –1 .
5-6. 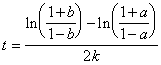 =13970 лет.
=13970 лет.
5-7. k 1 = 5.37 × 10 –3 с –1 , k 2 = 4.76 × 10 –3 с –1 .
5-8. k 1 = 0.025 мин –1 , k 2 = 0.014 мин –1 , k 3 = 0.031 мин –1 .
5-9. k 1 = 0.011 мин –1 , k 2 = 0.024 мин –1 , k 3 = 0.052 мин –1 .
5-10. Указание. Воспользуйтесь уравнением Аррениуса в виде E = RT 2 d ln k / dT .
*5-11. E 1 – E 2 = 48.2 кДж/моль.
5-13. [B] max = 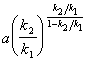 . 1) [B] max
. 1) [B] max
 ( ak 1 / k 2 ). 2) [B] max
( ak 1 / k 2 ). 2) [B] max  a .
a .
5-14. [B] = 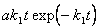 .
.
*5-15. 1) m ( 239 Np) = 44.46 г, m ( 239 Pu) = 0.100 г; 2)
m ( 239 Np) = 0.276 г, m ( 239 Pu) = 99.72 г. m max ( 239 Np) = 96.58 г.
*5-16. [A] = 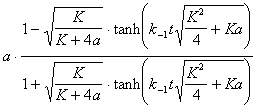 , где K = k 1 / k -1 — константа равновесия,
, где K = k 1 / k -1 — константа равновесия, 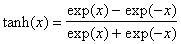 — гиперболический тангенс.
— гиперболический тангенс.
*5-17. [A] = 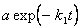 ,
,
[B] = 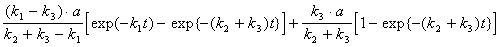 ,
,
[C] = a – [A] – [B]. Концентрация [B] достигает максимума, если выполнено условие:
k 1 > k 3 .
§ 7
7-1. 4 × 10 –5 с.
7-2. 1.52 × 10 –3 моль/(л × с).
7-3. 4.86 × 10 –4 моль/л.
7-4. 0.010 моль/л.
7-5. K M = 0.040 моль/л; w max = 4.4 × 10 –5 моль/(л × с).
7-6. K M = 0.083 моль/л; w max = 2.7 × 10 –5 моль/(л × с).
7-7. K M = 0.047 моль/л; w max = 5.7 × 10 –4 моль/(л × с).
7-8. 2.6 × 10 –3 моль/л.
7-9. 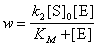
7-10. 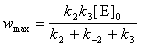 ,
, 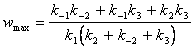
7-11. При конкурентном ингибировании прямые пересекаются на оси ординат ( w max одинакова),
при неконкурентном ингибировании — на оси абсцисс ( K M одинакова).
7-12. При конкурентном ингибировании прямые пересекаются на оси ординат ( w max одинакова),
при неконкурентном ингибировании прямые параллельны друг другу ( K M одинакова).
7-13. 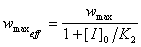 ,
, 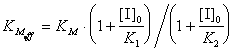 .
.
§ 8
8-1. l = 953 нм, n = 3.15 × 10 14 с –1 .
8-2. E кин = 113 ккал/моль.
8-3.  = 2.
= 2.
8-4.  = 0.167.
= 0.167.
8-5. 554 фотона.
8-6. 100 т.
8-7. 60 ккал.
8-8. 3.3 × 10 18 .
8-9. I f = k f × I /
( k f + k q × [Q]).
8-10. 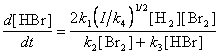
*8-11. Cl 2 + h 
 2Cl, I a
2Cl, I a
Cl + CHCl 3  CCl 3 + HCl, k 1
CCl 3 + HCl, k 1
CCl 3 + Cl 2  CCl 4 + Cl, k 2
CCl 4 + Cl, k 2
2CCl 3 + Cl 2  2CCl 4 , k 3
2CCl 4 , k 3
§ 9
9-1. k = 1.26 × 10 11 л/(моль × с).
9-2. P = 1.37 × 10 –3 .
9-3. E A = 167.1 кДж/моль.
*9-4. t 1/2 = 10.6 мин.
9-5. k ( T ) ~ T -1 × exp(- E 0 / RT ), k ( T ) ~ T 2 ×
exp(- E 0 / RT ).
9-6. k ( T ) ~ T × exp(- E 0 / RT ),
k ( T ) ~ exp(- E 0/ RT ).
9-7. k ( T ) ~ exp(- E 0 / RT ), k ( T ) ~ T × exp(- E 0 / RT ).
9-8. Линейную.
9-9. Нелинейную.
9-10. E 0 = E оп + 2 RT = 9.5 ккал/моль.
9-11. E оп = E 0 – (3/2) × RT при низких температурах.
9-12. E 0 = 234 кДж/моль.
9-13. 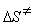 = 18.0 Дж/(моль × К).
= 18.0 Дж/(моль × К).
9-14. 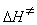 = 39.1 кДж/моль,
= 39.1 кДж/моль, 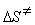 = 63.1 Дж/(моль × К).
= 63.1 Дж/(моль × К).
9-15. 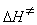 = 29.3 кДж/моль,
= 29.3 кДж/моль, 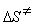 = –27.1 Дж/(моль × К).
= –27.1 Дж/(моль × К).
9-16. 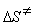 = –34.3 Дж/(моль × К).
= –34.3 Дж/(моль × К).
9-17. 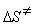 = –49.0 Дж/(моль × К),
= –49.0 Дж/(моль × К), 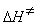 = 106.1 кДж/моль.
= 106.1 кДж/моль.
§ 10
10-1. 5.5× 10 –6 См м –1 .
10-2.138.3 См × см 2 × моль –1 .
10-3.387.9 См × см 2 × моль –1 .
10-4. 2.0 × 10 –2 См × м 2 × моль –1 .
10-5. 8.10 × 10 –6 моль·л –1 .
10-6. 0.319.
10-7. 0.82; 0.0028.
10-8. 3.5 × 10 –4 м × с –1 .
10-9. 5.2 × 10 –5 м × с –1 , 193 с.
10-10. 0.097.
10-11. 116.7 См × см 2 × моль –1 .
10-12. r = 2.0 Å;  0 = 2.7 ´ 10 –2 См × см 2 × моль –1 .
0 = 2.7 ´ 10 –2 См × см 2 × моль –1 .
10-13. 19.9 См × см 2 × моль –1 ; 191.1 См × см 2 × моль –1 .
10-14. k = 0.1264 См × м –1 ; x (Na + ) = 2.46 мм; x (Cl – ) = 3.75 мм.
10-15. r = 2.5 Å; n (H 2 O) = 5.
10-16. 0.179 моль × л –1 ; 2.737 ´ 10 –4 См × м 2 × моль –1 .
10-17. K = 1.75 × 10 -7 моль × л –1 ; pH = 5.29.
10-18. a = 0.125; [H + ] = 1.22 × 10 -4 моль × л -1 ;  0 = 330.7 См × см 2 × моль -1 .
0 = 330.7 См × см 2 × моль -1 .
10-19. K = 5.6 × 10 -4 моль × л -1 ;  = 0.09; [OH – ] = 5.6 × 10 -3 моль × л -1 .
= 0.09; [OH – ] = 5.6 × 10 -3 моль × л -1 .
§ 11
11-1. 0.594.
11-2 0.163 моль × л –1 .
11-3. 0.67.
11-4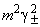 ,
, 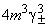 ,
, 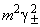 ,
, 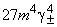 .
.
11-5. 0.00634.
11-6. 7.44 × 10 –5 .
11-7. a ± = 0.139; a = 3.74 ×10 –4 .
11-8. 0.90 моль × кг -1 .
11-9. 0.320 моль × кг -1 .
11-10. 0.05 моль × кг -1 .
11-11. 0.02 моль × кг -1 .
11-12. 0.06 моль × кг -1 .
11-13. 2.73 г.
11-14.
 (K + ) = 0.895;
(K + ) = 0.895;
 (Al 3+ ) = 0.367;
(Al 3+ ) = 0.367;
 (SO
4 2– ) = 0.641.
(SO
4 2– ) = 0.641.
11-15.
 (Ca 2+ ) = 0.695;
(Ca 2+ ) = 0.695;
 (Cl – ) = 0.913;
(Cl – ) = 0.913;
 ± = 0.834.
± = 0.834.
11-16.
 (Ca 2+ ) =
(Ca 2+ ) =
 (SO 4 2– ) =
(SO 4 2– ) =
 ± = 0.657.
± = 0.657.
11-17. 1.4%.
11-18. 1×10 4 %.
11-19. 0.905.
11-20. 2.88 × 10 –9 моль × кг –1 .