|
Учебные материалы по физической химии
Задачи по физической химии.Часть 2.Химическая кинетика. Электрохимия
9. Теории химической кинетики
Основная задача теорий химической кинетики -
предложить способ расчета константы скорости
элементарной реакции и ее зависимости от
температуры, используя различные представления
о строении реагентов и пути реакции. Мы
рассмотрим две простейшие теории кинетики -
теорию активных столкновений (ТАС) и теорию
активированного комплекса (ТАК).
Теория активных столкновений основана на
подсчете числа столкновений между реагирующими
частицами, которые представляются в виде твердых
сфер. Предполагается, что столкновение приведет
к реакции, если выполняются два условия: 1)
поступательная энергия частиц превышает энергию
активации EA; 2) частицы правильно
ориентированы в пространстве относительно друг
друга. Первое условие вводит в выражение для
константы скорости множитель exp(-EA/RT),
который равен доле активных столкновений в
общем числе столкновений. Второе условие дает
так называемый стерический множитель P -
константу, характерную для данной реакции.
В ТАС получены два основных выражения для
константы скорости бимолекулярной реакции. Для
реакции между разными молекулами (A + B  продукты) константа скорости равна продукты) константа скорости равна
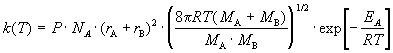 (9.1) (9.1)
Здесь NA - постоянная Авогадро, r -
радиусы молекул, M - молярные массы веществ.
Множитель в больших круглых скобках - это средняя
скорость относительного движения частиц A и B.
Константа скорости бимолекулярной реакции
между одинаковыми молекулами (2A  продукты) равна: продукты) равна:
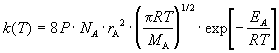 (9.2) (9.2)
Из (9.1) и (9.2) следует, что температурная
зависимость константы скорости имеет вид:
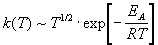 . .
Согласно ТАС, предэкспоненциальный множитель
слабо зависит от температуры. Опытная энергия
активации Eоп, определяемая по
уравнению (4.4), связана с аррениусовской, или
истинной энергией активации EA
соотношением:
Eоп = EA - RT/2.
Мономолекулярные реакции в рамках ТАС
описывают с помощью схемы Линдемана (см. задачу
6.4), в которой константу скорости активации k1
рассчитывают по формулам (9.1) и (9.2).
В теории активированного комплекса
элементарную реакцию представляют как
мономолекулярный распад активированного
комплекса по схеме:
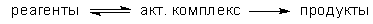
Предполагается, что между реагентами и
активированным комплексом существует
квазиравновесие. Константу скорости
мономолекулярного распада рассчитывают
методами статистической термодинамики,
представляя распад как одномерное
поступательное движение комплекса по координате
реакции.
Основное уравнение теории активированного
комплекса имеет вид:
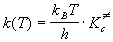 , (9.3) , (9.3)
где kB = 1.38.10-23 Дж/К -
постоянная Больцмана, h = 6.63.10-34 Дж.
с - постоянная Планка, 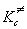 -
константа равновесия образования
активированного комплекса, выраженная через
молярные концентрации (в моль/л). В зависимости от
того, как оценивают константу равновесия,
различают статистический и термодинамический
аспекты ТАК. -
константа равновесия образования
активированного комплекса, выраженная через
молярные концентрации (в моль/л). В зависимости от
того, как оценивают константу равновесия,
различают статистический и термодинамический
аспекты ТАК.
В статистическом подходе константу
равновесия выражают через суммы по состояниям:
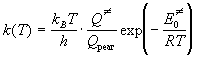 , (9.4) , (9.4)
где 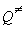 - полная сумма по
состояниям активированного комплекса, Qреаг
- произведение полных сумм по состояниям
реагентов, - полная сумма по
состояниям активированного комплекса, Qреаг
- произведение полных сумм по состояниям
реагентов, 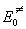 - энергия
активации при абсолютном нуле, T = 0. - энергия
активации при абсолютном нуле, T = 0.
Полные суммы по состояниям обычно разлагают на
сомножители, соответствующие отдельным видам
движения молекул: поступательному, электронному,
вращательному и колебательному:
Q = Qпост. Qэл..
Qвр.. Qкол.
Поступательная сумма по состояниям для частицы
массой m равна:
Qпост = 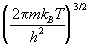 . .
Эта поступательная сумма имеет размерность
(объем)-1, т.к. через нее выражаются
концентрации веществ.
Электронная сумма по состояниям при обычных
температурах, как правило, постоянна и равна
вырожденности основного электронного состояния:
Qэл = g0.
Вращательная сумма по состояниям для
двухатомной молекулы равна:
Qвр = 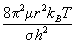 , ,
где m = m1m2 / (m1+m2)
- приведенная масса молекулы, r - межъядерное
расстояние, s = 1 для несимметричных молекул AB и s =2
для симметричных молекул A2. Для линейных
многоатомных молекул вращательная сумма по
состояниям пропорциональна T, а для
нелинейных молекул - T 3/2. При обычных
температурах вращательные суммы по состояниям
имеют порядок 101-102.
Колебательная сумма по состояниям молекулы
записывается как произведение сомножителей,
каждый из которых соответствует определенному
колебанию:
Qкол = 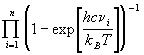 , ,
где n - число колебаний (для линейной
молекулы, состоящей из N атомов, n = 3N-5,
для нелинейной молекулы n = 3N-6), c = 3.1010
см/с - скорость света, n i - частоты
колебаний, выраженные в см-1. При обычных
температурах колебательные суммы по состояниям
очень близки к 1 и заметно отличаются от нее
только при условии: T > n . При очень высоких
температурах колебательная сумма для каждого
колебания прямо пропорциональна температуре:
Qi 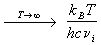 . .
Отличие активированного комплекса от обычных
молекул состоит в том, что он имеет на одну
колебательную степень свободы меньше, а именно:
то колебание, которое приводит к распаду
комплекса, не учитывается в колебательной сумме
по состояниям.
В термодинамическом подходе константу
равновесия выражают через разность
термодинамических функций активированного
комплекса и исходных веществ. Для этого
константу равновесия, выраженную через
концентрации, переводят в константу, выраженную
через давления. Последняя константа, как
известно, связана с изменением энергии Гиббса в
реакции образования активированного комплекса:
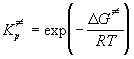 . .
Для мономолекулярной реакции, в которой
образование активированного комплекса
происходит без изменения числа частиц, 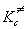 = = 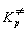 и константа скорости выражается
следующим образом: и константа скорости выражается
следующим образом:
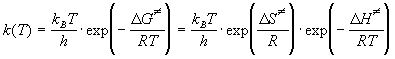 . (9.5) . (9.5)
Энтропийный множитель exp ( S S  /R) иногда интерпретируют
как стерический множитель P из теории
активных столкновений. /R) иногда интерпретируют
как стерический множитель P из теории
активных столкновений.
Для бимолекулярной реакции, протекающей в
газовой фазе, в эту формулу добавляется
множитель RT / P0 (где P0 = 1
атм = 101.3 кПа), который нужен для перехода от 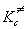 к к 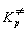 : :
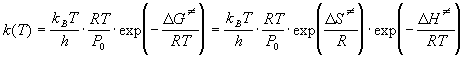 . (9.6) . (9.6)
Для бимолекулярной реакции в растворе
константу равновесия 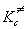 выражают через энергию Гельмгольца образования
активированного комплекса:
выражают через энергию Гельмгольца образования
активированного комплекса:
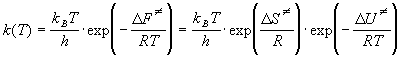 . (9.7) . (9.7)
ПРИМЕРЫ
Пример 9-1. Константа скорости бимолекулярной
реакции
2NO2  2NO + O2 2NO + O2
при 627 К равна 1.81.103 см3/(моль.
с). Вычислите истинную энергию активации и долю
активных молекул, если диаметр молекулы NO2
можно принять равным 3.55 А, а стерический
множитель для этой реакции равен 0.019.
Решение. При расчете будем опираться на
теорию активных столкновений (формула (9.2)):
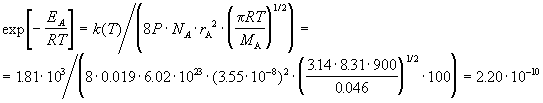 . .
Это число представляет собой долю активных
молекул.
При расчетах констант скорости с
использованием различных теорий химической
кинетики необходимо очень аккуратно обращаться
с размерностями. Обратите внимание на то, что
радиус молекулы и средняя скорость выражены
через см для того, чтобы получить константу в см3/(моль.
с). Коэффициент 100 служит для перевода м/с в см/с.
Истинную энергию активации легко вычислить
через долю активных молекул:
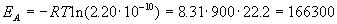 Дж/моль = 166.3
кДж/моль. Дж/моль = 166.3
кДж/моль.
Пример 9-2. Используя теорию активированного
комплекса, определите температурную зависимость
константы скорости тримолекулярной реакции 2NO + Cl2
= 2NOCl при температурах, близких к комнатной.
Найдите связь между опытной и истинной энергиями
активации.
Решение. Согласно статистическому вариант
ТАК, константа скорости равна (формула (9.4)):
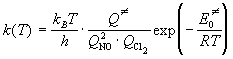 . .
В суммах по состояниям активированного
комплекса и реагентов мы не будем учитывать
колебательные и электронные степени свободы, т.к.
при низких температурах колебательные суммы по
состояниям близки к единице, а электронные -
постоянны.
Температурные зависимости сумм по состояниям с
учетом поступательного и вращательного движений
имеют вид:
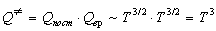 , ,
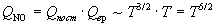 , ,
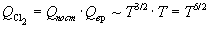 . .
Активированный комплекс (NO)2Cl2 -
нелинейная молекула, поэтому его вращательная
сумма по состояниям пропорциональна T3/2.
Подставляя эти зависимости в выражение для
константы скорости, находим:
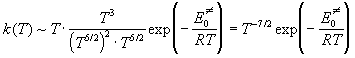 . .
Мы видим, что тримолекулярные реакции
характеризуются довольно необычной
зависимостью константы скорости от температуры.
При определенных условиях константа скорости
может даже убывать с ростом температуры за счет
предэкспоненциального множителя!
Опытная энергия активации этой реакции равна:
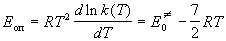 . .
Пример 9-3. Используя статистический вариант
теории активированного комплекса, получите
выражение для константы скорости
мономолекулярной реакции.
Решение. Для мономолекулярной реакции
A  AN AN  продукты продукты
константа скорости, согласно (9.4), имеет вид:
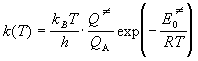 . .
Активированный комплекс в мономолекулярной
реакции представляет собой возбужденную
молекулу реагента. Поступательные суммы
реагента A и комплекса AN одинаковы (масса
одинакова). Если предположить, что реакция
происходит без электронного возбуждения, то и
электронные суммы по состояниям одинаковы. Если
предположить, что при возбуждении строение
молекулы реагента изменяется не очень сильно, то
вращательные и колебательные суммы по
состояниям реагента и комплекса почти одинаковы
за одним исключением: активированный комплекс
имеет на одно колебание меньше, чем реагент.
Следовательно, колебание, приводящее к разрыву
связи, учитывается в сумме по состояниям
реагента и не учитывается в сумме по состояниям
активированного комплекса.
Проводя сокращение одинаковых сумм по
состояниям, находим константу скорости
мономолекулярной реакции:
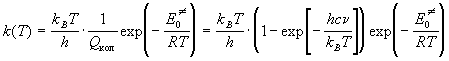 , ,
где n - частота колебания, которое приводит к
реакции. Скорость света c - это множитель,
который используют, если частота колебания
выражена в см-1. При низких температурах
колебательная сумма по состояниям равна 1:
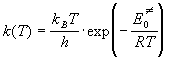 . .
При высоких температурах экспоненту в
колебательной сумме по состояниям можно
разложить в ряд: exp(-x) ~ 1 - x:
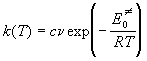 . .
Этот случай соответствует ситуации, когда при
высоких температурах каждое колебание приводит
к реакции.
Пример 9-4. Определите температурную
зависимость константы скорости для реакции
молекулярного водорода с атомарным кислородом:
H2 + O.  HO. + H. (линейный активированный
комплекс) HO. + H. (линейный активированный
комплекс)
при низких и высоких температурах.
Решение. По теории активированного комплекса
константа скорости для этой реакции имеет вид:
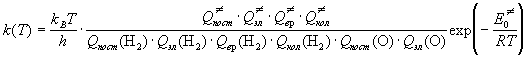 . .
Будем считать, что электронные множители от
температуры не зависят. Все поступательные суммы
по состояниям пропорциональны T3/2,
вращательные суммы по состояниям для линейных
молекул пропорциональны T, колебательные
суммы по состояниям при низких температурах
равны 1, а при высоких температурах
пропорциональны температуре в степени, равной
числу колебательных степеней свободы (3N - 5 = 1
для молекулы H2 и 3N - 6 = 3 для линейного
активированного комплекса). Учитывая все это,
находим, что при низких температурах
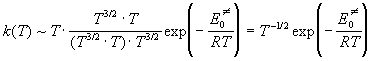 , ,
а при высоких температурах
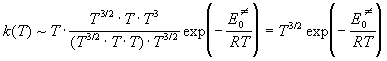 . .
Пример 9-5. Кислотно-основная реакция в
буферном растворе протекает по механизму: A-
+ H+  P. Зависимость
константы скорости от температуры дается
выражением P. Зависимость
константы скорости от температуры дается
выражением
k = 2.05 .1013. e-8681/T (л.
моль-1. с-1).
Найдите опытную энергию активации и энтропию
активации при 30 оС.
Решение. Так как бимолекулярная реакция
происходит в растворе, для расчета
термодинамических функций используем выражение
(9.7). В это выражение нужно ввести опытную энергию
активации. Поскольку предэкспоненциальный
множитель в (9.7) линейно зависит от T, то Eоп
= 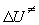 + RT. Заменяя в (9.7) + RT. Заменяя в (9.7) 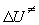 на Eоп, получим: на Eоп, получим:
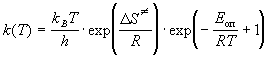 . .
Отсюда следует, что опытная энергия активации
равна Eоп = 8681. R = 72140 Дж/моль.
Энтропию активации можно найти из
предэкспоненциального множителя:
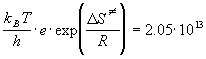 , ,
откуда 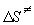 = 1.49 Дж/(моль.
К). = 1.49 Дж/(моль.
К).
ЗАДАЧИ
9-1. Диаметр метильного радикала равен 3.8 А.
Какова максимальная константа скорости (в
л/(моль. с)) реакции рекомбинации метильных
радикалов при 27 оС?(ответ)
9-2. Вычислите значение стерического
множителя в реакции димеризации этилена
2C2H4  C4H8
C4H8
при 300 К, если опытная энергия активации равна
146.4 кДж/моль, эффективный диаметр этилена равен
0.49 нм, а опытная константа скорости при этой
температуре равна 1.08. 10-14 см3/(моль. с).(ответ)
9-3. Опытная константа скорости реакции
C2H4 + H2 ѕ  C2H6 C2H6
равна 1.77. 10-2 л/(моль. с) при 787 К. Средний
диаметр молекулы этилена - 2 А, молекулы водорода -
1 А, стерический множитель равен 0.05. Найдите
истинную энергию активации этой реакции.(ответ)
*9-4. Термическое разложение ацетальдегида -
бимолекулярная реакция. Опытная энергия
активации равна 45.5 ккал/моль, а диаметр молекулы -
4.5 А. Рассчитайте период полупревращения этой
реакции при давлении 1 атм и температуре 800 К.(ответ)
9-5. Определите температурную зависимость
константы скорости для реакции N2 + O2  2NO при низких и высоких
температурах.(ответ) 2NO при низких и высоких
температурах.(ответ)
9-6. Определите температурную зависимость
константы скорости для реакции CH3I  CH3. + I. при
низких и высоких температурах.(ответ) CH3. + I. при
низких и высоких температурах.(ответ)
9-7. Определите температурную зависимость
константы скорости для реакции H. + Br2  HBr + Br. (нелинейный
активированный комплекс) при низких и высоких
температурах.(ответ) HBr + Br. (нелинейный
активированный комплекс) при низких и высоких
температурах.(ответ)
9-8. Для реакции CO + O2 = CO2 + O
зависимость константы скорости от температуры
при низких температурах имеет вид:
k(T) ~ T-3/2. exp(-E0/RT)
Какую конфигурацию - линейную или нелинейную -
имеет активированный комплекс?(ответ)
9-9. Для реакции 2NO = (NO)2 зависимость
константы скорости от температуры при невысоких
температурах имеет вид:
k(T) ~ T-1 exp(-E0/RT)
Какую конфигурацию - линейную или нелинейную -
имеет активированный комплекс?(ответ)
9-10. Используя теорию активного комплекса,
вычислите истинную энергию активации E0
для реакции
CH3. + C2H6  CH4 + C2H5. CH4 + C2H5.
при T = 300 K, если опытная энергия активации
при этой температуре равна 8.3 ккал/моль .(ответ)
9-11. Выведите соотношение между опытной и
истинной энергиями активации для реакции
2AB  линейный
комплекс (ответ) линейный
комплекс (ответ)
9-12. Определите энергию активации
мономолекулярной реакции при 1000 К, если частота
колебаний по разрываемой связи равна n = 2.4.1013
с-1, а константа скорости равна k = 510 мин-1.(ответ)
9-13. Константа скорости реакции первого
порядка разложения бромэтана при 500 оС
равна 7.3.1010 с-1. Оцените энтропию
активации этой реакции, если энергия активации
равна 55 кДж/моль. (ответ)
9-14. Разложение перекиси ди-трет-бутила в
газовой фазе представляет собой реакцию первого
порядка, константа скорости которой (в с-1)
зависит от температуры следующим образом:
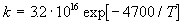
Используя теорию активированного комплекса,
рассчитайте энтальпию и энтропию активации при
температуре 200 оС. (ответ)
9-15. Изомеризация диизопропилового эфира в
аллилацетон в газовой фазе представляет собой
реакцию первого порядка, константа скорости
которой (в с-1) зависит от температуры
следующим образом:
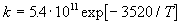
Используя теорию активированного комплекса,
рассчитайте энтальпию и энтропию активации при
температуре 400 оС. (ответ)
9-16. Зависимость константы скорости
разложения винилэтилового эфира
C2H5-O-CH=CH2 C2H4 + CH3CHO C2H4 + CH3CHO
от температуры имеет вид
k = 2.7. 1011. e-10200/T (с-1).
Рассчитайте энтропию активации при 530 оС. (ответ)
9-17. В газовой фазе вещество А мономолекулярно
превращается в вещество В. Константы скорости
реакции при температурах 120 и 140 оС равны,
соответственно, 1.806.10-4 и 9.14.10-4
с-1. Рассчитайте среднюю энтропию и теплоту
активации в этом температурном интервале. (ответ)
| 
