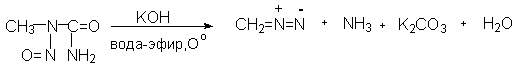
IV. АЛИФАТИЧЕСКИЕ ДИАЗОСОЕДИНЕНИЯ (ДИАЗОАЛКАНЫ).
Строение алифатических диазосоединений может быть выражено общей формулой R2C=N+=N-. Отрицательный заряд в диазоалкане распределен между концевым атомом азота и углеродом в результате мезомерного эффекта R2C = N+ = N- , что отражает его свойства как нуклеофильного реагента. При протонировании или при взаимодействии с кислотами Льюиса образуется электронодефицитная частица, обладающая свойствами мощного электрофильного агента, поэтому для диазоалканов характерны свойства бифильного реагента. Диазоалканы относятся к числу реакционноспособных и нестабильных соединений. Газообразный диазометан разлагается со взрывом при комнатной температуре при соприкосновении со шлифованной или шероховатой поверхностью, поэтому при работе с газообразным диазометаном не рекомендуется использовать посуду со шлифами. В отличие от этого раствор диазометана в эфире сохраняется при -20о в течение длительного времени. Пары диазометана ядовиты, он вызывает приступ астмы и раздражает глаза. Гомологи диазометана еще менее стабильны и раствор диметилдиазометана в эфире разлагается при -20о в течение нескольких минут. Диарилдиазометаны Ar2C=N=N отличаются от диазоалканов гораздо более высокой стабильностью.
IV.1. Получение диазоалканов.
Лучшим в настоящее время способом получения диазометана остается метод предложенный еще в 1930 году Ф.Арндтом и заключающийся в обработке N- нитрозометилмочевины концентрированным раствором щелочи в бинарной системе вода - эфир при 0-5о. Образующийся при этом газообразный диазометан хранят в растворе в эфире при 0-(-20о). Следует особо отметить, что N-нитрозометилмочевина, также как и другие N-нитрозопроизводные канцерогенна.
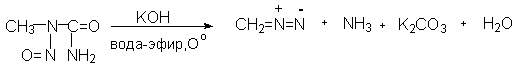
Все остальные способы получения диазометана и его простейших гомологов очень похожи и различаются только природой уходящей группы.
Реакция щелочного разложения включает две стадии. В первой стадии ацильный или сульфонильный остаток Y мигрирует от азота к кислороду нитрозогруппы. Далее следует депротонирование и отщепление остатка YO .
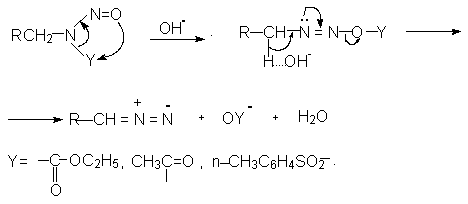
Диазосоединения могут быть получены также окислением соответствующих гидразонов желтой окисью ртути в эфире или бензоле.
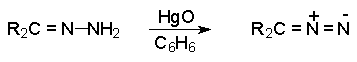
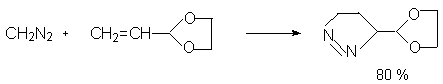
Этот путь используют для получения арилзамещенных диазоалканов, а также для получения циклодиазоалканов.
Диазокетоны получают ацилированием диазометана ацилгалогенидами.
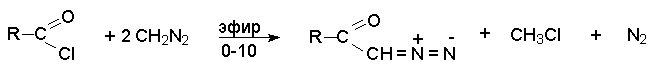
Избыток диазометана необходим для связывания образующегося хлористого водорода.
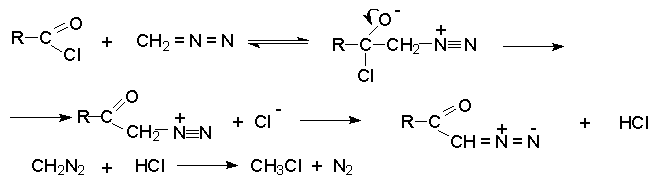
Введение диазогруппы в 1,3-дикетоны и 1,3-кетоэфиры осуществляется с помощью тозилазида п-CH3C6H4SO2-N=N+=N- в двухфазной системе вода - хлористый метилен и соли тетраалкиламмония в качестве катализатора межфазного переноса.
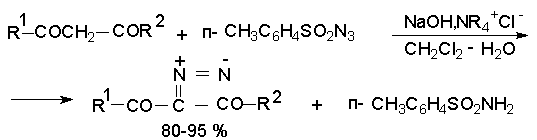
Эта реакция имеет общий характер для соединений, содержащих метиленовую группу, активированную двумя электроноакцепторными заместителями (COR, COOR, NO2, CN).
Диазоэфиры образуются при нитрозировании
эфиров ![]() -аминокислот.
-аминокислот.
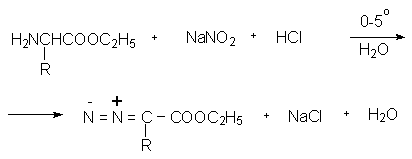
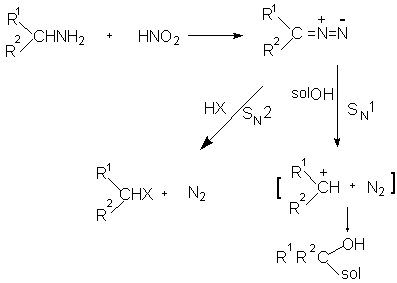
Диазокетоны и диазоэфиры гораздо стабильнее диазоалканов и легко выделяются в индивидуальном виде. Как уже было отмечено ранее, алифатические диазониевые соли невозможно выделить в реакции нитрозирования первичных алифатических аминов. Диазониевые соли алифатического ряда спонтанно разлагаются с выделением азота либо в результате атаки нуклеофильного реагента по механизму SN2, либо в результате образования "горячего" карбокатиона по механизму SN1.
IV.2. Свойства диазоалканов.
Диазометан и другие диазоалканы количественно реагируют с гидроксильной группой карбоновых кислот, фенолoв и енолов, а при катализе эфиратом трехфтористого бора и со спиртами в эфирном растворе при -10 –( -20o).
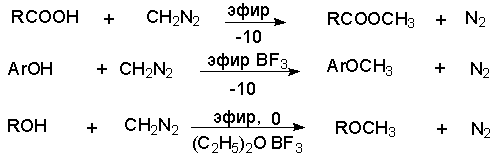
Предполагается, что в каждой из этих реакций в первой стадии происходит перенос протона к диазометану с образованием крайне нестабильного катиона метилдиазония CH3N2+, который затем взаимодействует с карбоновой кислотой или другим нуклеофильным агентом с образованием конечного продукта метилирования.
![]()
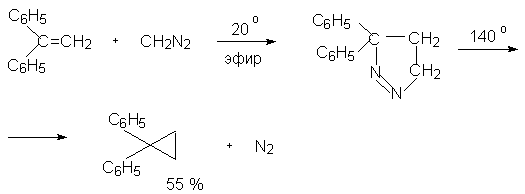
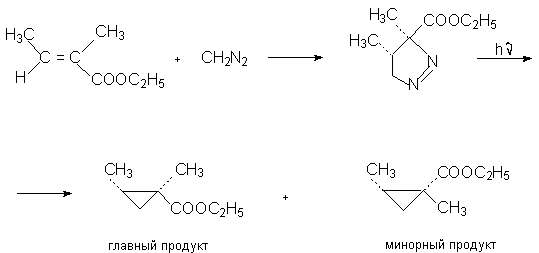
Простейшие алифатические диазосоединения ранее использовались для генерирования карбенов в реакции циклоприсоединения к алкенам. Диазометан при облучении разлагается на карбен - метилен и азот.
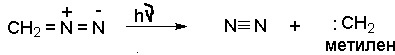
При фотолизе диазометана образуется метилен в синглетной форме. Синглетный метилен синхронно присоединяется к двойной связи алкена с образованием производных циклопропана с сохранением геометрии заместителей при двойной связи.
Разновидностью этого способа генерации карбена является каталитическое разложение диазосоединений, и в первую очередь, диазоуксусного эфира в присутствии солей меди,а также ионов других переходных металлов.
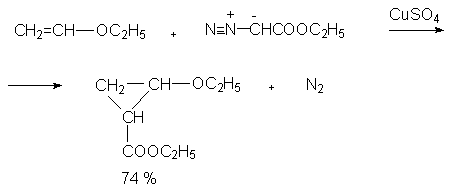
Взаимодействие альдегидов и кетонов с диазометаном представляет собой метод получения гомологов карбонильных соединений,имеющий ограниченную область применения. В качестве побочных продуктов образуются оксираны.
В первой стадии в результате нуклеофильного присоединения диазометана к карбонильной группе образуется бетаин. Бетаин стабилизируется двумя альтернативными путями - замыканием трехчленного цикла в результате нуклеофильной SN2 - атаки кислорода по метиленовой группе с одновременным отщеплением молекулярного азота, либо за счет миграции группы R.
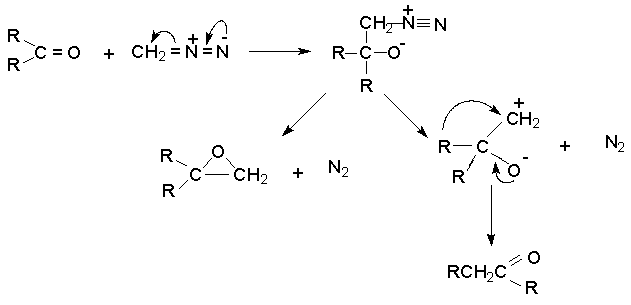
Альдегиды в реакции с диазометаном дают метилкетоны и оксираны, но не гомологи альдегидов. Это указывает на то, что гидрид - ион мигрирует легче, чем алкильная группа. Алифатические альдегиды при взаимодействии с диазометаном дают метилкетоны с удовлетворительным выходом порядка 30-75 %, в то же время как для ароматических альдегидов выход арилметилкетонов значительно выше. Реакция диазометана с алифатическими кетонами не имеет практического значения, поскольку выход гомологов кетонов не превышает 20-30 %, а для несимметричных кетонов получаются оба возможных гомолога наряду со значительным количеством оксирана.
Практическое значение эта реакция приобрела только для некоторых циклических кетонов ка метод расширения цикла. Образование оксиранов можно свести к минимуму, если проводить реакцию в присутствии сильных кислот Льюиса - бромида или хлорида алюминия. Кислота Льюиса блокирует неподеленную пару электронов атома кислорода в бетаине, что препятствует замыканию оксиранового цикла.
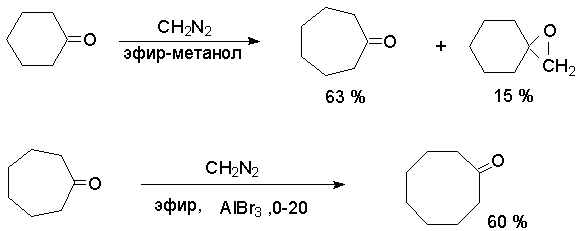
Фактически реакция расширения цикла циклоалканонов пригодна только для получения циклогептанона и циклооктанона, для больших циклов эта реакция не имеет практического значения.
Перегруппировка Вольфа представляет собой превращение диазокарбонильных соединений в кетены, катализируемое ионами серебра или облучением. Эта перегруппировка лежит в основе общего метода синтеза карбоновых кислот по Арндту - Эйстерту.
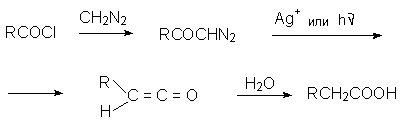
Особую группу реакций диазоалканов составляют так называемые реакции 1,3-диполярного циклоприсоединения к активированным алкенам и алкинам.