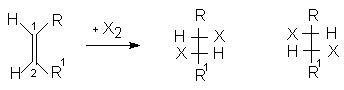
трео-изомеры
3.1. D,L-2,3-дибромянтарная кислота.
При присоединении галогенов к 1,2-дизамещенным олефинам стереоселективно образуются диастереомерные 1,2-дигалогенопроизводные с трео- или эритро- конфигурацией.
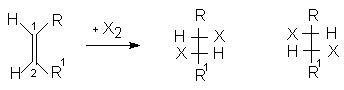 |
|
трео-изомеры |
|
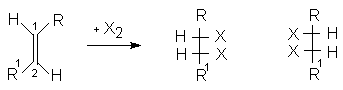 эритро-изомеры
эритро-изомеры
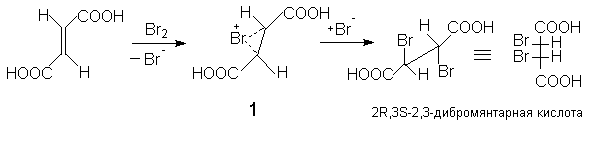
Если 1,2-заместители при двойной связи одинаковы, то пролучают в зависимости от конфигурации двойной С=С связи (Z или E) или рацемическую смесь энантиомеров (1:1) или мезо-форму. Поэтому присоединение брома к малеиновой кислоте приводит к D,L-2,3-дибромянтарной кислоте (смесь 2R,3R- и 2S,3S-энантиомеров).
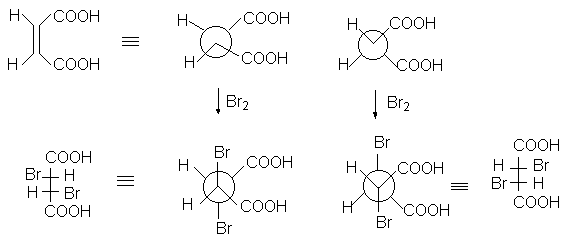 |
|
| 2R,3R-2,3-дибромянтарная кислота | 2S,3S-2,3-дибромянтарная кислота |
Бромирование фумаровой кислоты приводит к образованию мезо-2,3-дибромянтарной кислоты (2R,3S; 2S,3R).
Предполагается, что образование стереоселективных продуктов происходит через промежуточное образование циклического бромониевого иона (I), который атакуется бромид-анионом с противоположной стороны.
Методика.
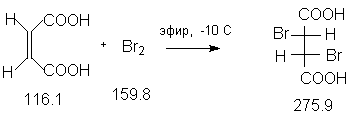
Константы исходных и синтезированных соединений. Приведены : формула, т.пл.оС, т.кип.оС.
Z-HOOC-CH=CH-COOH,130 ;
Br2,-7.2, 58.7, d420 3.14 ;
(C2H5)2O,-116, 34.5,d420
0.7138 ;
петролейный эфир,-,40-80 ;
D,L-HOOC-CHBr-CHBr-COOH, 166-167.
Проведение синтеза.
В трехгорлую колбу (250 мл), снабженную магнитной мешалкой, внутренним термометром и обратным холодильником помещают 70 мл абсолютного диэтилового эфира (прибор 4, без капельной воронки). Колбу защищают от света алюминиевой фольгой и охлаждают до –10оС (лед+соль). При интенсивном перемешивании последовательно прибавляют 8.79 г(0.055 моля, 2.8 мл) брома (синтез проводят под тягой!) и порциями 5.81 г (0.05 моля) тонко измельченной малеиновой кислоты. После прибавления снимают охлаждение и перемешивают до тех пор, пока реакционная смесь не достигнет комнатной температуры. О начале протекания реакции можно судить по быстрому подьему температуры. После 30-минутного перемешивания реакция заканчивается.
Обработка реакционной смеси.
Эфирный раствор переносят в делительную воронку и последовательно промывают водой(15 мл), 0.2 М раствором сульфита натрия(30 мл) и дважды водой (2х15 мл). Сушат сульфатом магния. Эфир отгоняют при атмосферном давлении (прибор 12), затем на роторном испарителе при небольшом вакууме. Маслянистый остаток кристаллизуется при растирании стеклянной палочкой,т.пл. 163-165 о С.
Очистка.
Полученные кристаллы промывают небольшим количеством петролейного эфира (т.кип. 40-80 о С), отфильтровывают и сушат в вакуум-эксикаторе. Получают 9.66 г (70 %) D,L-дибромянтарной кислоты в виде бесцветных кристаллов, т.пл. 166-167 о С.
Методы обработки реакционной смеси : 2.1; 2.2; 2.3; 3.4.
Выделение полученного соединения : 3.2; 2.2.
Примечание: эфир для проведения синтеза используют абсолютно сухой. В противном случае бром реагирует с водой с образованием HBr, последний способствует каталитической изомеризации малеиновой кислоты в фумаровую.
Рециклизация и использование.
Продукт является исходным соединением в синтезе броммалеиновой кислоты. Из реакционной смеси выделяют около 70 мл диэтилового эфира, который после повторной перегонки пригоден для бромирования малеиновой кислоты.
Отходы безвредные ( сбрасывают в канализацию):~30 мл промывных вод.
Отходы требующие обезвреживания (утилизации): осушитель, 30 мл раствора Na2SO3 и примерно 10 мл петролейного эфира.
3.2. мезо-2,3-Дибромянтарная кислота.
Методика получения.
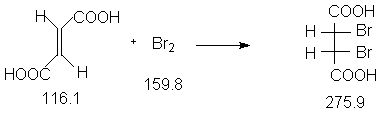
Константы исходных и синтезированных соединений. Приведены : формула. т.пл.оС,т.кип.оС.
Е-HOOC-CH=CH-COOH,300,- ;
Br2, -7.2, 58.7, d420 3.14 ;
AgNO3, 212, 444 ;
мезо - HOOC-(Br)HC-CH(Br)-COOH, 256-257.
Проведение синтеза.
В трехгорлой колбе (250 мл), снабженной магнитной мешалкой, капельной воронкой и обратным холодильником (прибор 5), нагревают до кипения суспензию 5.81 г(0.05 моля) фумаровой кислоты в 40 мл воды. К кипящей реакционой массе добавляют 8.79 г(0.055 моля, 2.8 мл) брома с такой скоростью, чтобы бром не улетал (~1 час, тяга !). К концу реакции небольшой избыток брома остается. В процессе добавления брома в колбе выпадает кристаллический осадок.
Обработка реакционной смеси.
Полная кристаллизация завершается после охлаждения реакционной смеси при перемешивании до 10оС на ледяной бане. Осадок отфильтровывают на стеклянном фильтре (прибор 10) и многократно промывают ледяной водой (порциями по 5 мл) до обесцвечивания. Определяют выход неочищенного продукта.
Очистка.
Осадок перекристаллизовывают из 2N HCl. Следует обратить внимание на то, чтобы после перекристаллизации и многократного промывания осадка ледяной водой, промывные воды не содержали хлорид-анионов (тест с помощью раствора AgNO3). После высушивания при Т=120оС получают 9.0 г(65 %) мезо-1,2-дибромянтарной кислоты с т.пл. 256-257оС.
Продукт является исходным соединением для синтеза броммалеиновой кислоты.
Отходы безвредные сбрасывают в канализацию : ~100 мл кислого маточного раствора и промывные воды.
Отходы, подлежащие утилизации : ~60 мл маточного раствора.
Выделение полученного продукта :3.1, 3.2.
3.3. цис-Циклогексан-1,2-диол.
Алкены окисляются перманганатом калия или тетраоксидом осмия в водном растворе до 1,2-диолов.
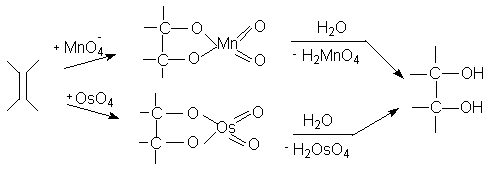
Образующиеся промежуточно циклические эфиры марганца и осмия обусловливают протекание стереоселективного син-присоединения обоих атомов кислорода по sp2-углеродным атомам двойной связи. Так, при окислении циклических олефинов, например, циклогексена, образуются цис-циклоалкан-1,2-диолы (син- или цис-гидроксилирование алкенов).
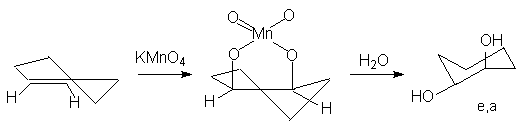 -
-
Ациклические алкены определенной конфигурации также гидроксилируются стереоселективно : (Е)-алкены дают трео-1,2-диолы, (Z )-алкены – эритро-1,2-диолы, симметричные (Z)-алкены дают мезо-1,2-диолы.
Методика.
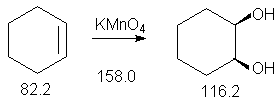
Константы исходных и синтезированных соединений. Приведены формула,т.пл.оС, т.кип.о С, d420.
Циклогексен,-103.5, 83.3, 0.81;
C2H5OH,-117.0, 78.4, 0.79 ;
KMnO4,240, - ;
CH3COCH3,-94.9, 56.5, 0.79 ;
CHCl3,-635, 61.7, 1.48 ;
петролейный эфир,-,40-80 ;
цис-циклогексан-1,2-диол,100-101.
Проведение синтеза.
В трехгорлой колбе (500 мл), снабженной механической мешалкой, обратным холодильником и капельной воронкой (прибор 3) растворяют 8.2 г (0.01 моля) циклогексена в 180 мл этанола и охлаждают раствор до –10оС (лед+соль). По каплям прибавляют раствор 13.4 г(0.084 моля) перманганата калия и 10 г(0.083 моля) сульфата магния в 250 мл воды с такой скоростью, чтобы температура реакционной смеси была 0-5оС (время прибавления ~1.5-2 часа). После добавления реагента смесь перемешивают еще 0.5 часа при охлаждении ледяной водой.
Обработка реакционной смеси.
Образующийся в результате реакции коричневый осадок отфильтровывают под тягой (запах циклогексена) и промывают ацетоном (3х60 мл). Если фильтрат мутный, фильтруют еще раз. Фильтрат упаривают в вакууме до обьема 120 мл, насыщают хлоридом натрия и экстрагируют хлороформом (5х40 мл). Обьединенные эфирные вытяжки высушивают сульфатом натрия и отгоняют растворитель. Оставшееся масло кристаллизуется в течение нескольких минут. Кристаллы отфильтровывают и промывают петролейным эфиром.
Очистка.
Продукт с т.пл. 86-88оС перекристаллизовывают из циклогексана.
Выход очищенного продукта составляет 2.93 г (25 %) цис-1,2-циклогександиола с т.пл. 100-101оС (бесцветные кристаллы).
Примечание:~ 200 мл хлороформа,~50 мл петролейного эфира и 20 мл циклогексана могут быть собраны и очищены перегонкой. Отходы, подлежащие утилизации: осадок H3MnO4, осушитель,~ 500 мл дистиллата,~ 100 мл водной фазы.
3.4. транс-Циклогексан-1,2-диол.
Кислый гидролиз оксиранов приводит к образованию 1,2-диолов.
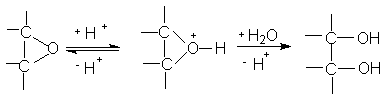
Определяющей стадией этой реакции является раскрытие протонированного оксиранового кольца (SN2 реакция) при атаке воды в качестве нуклеофила с обратной стороны оксиранового кольца. Согласно этому механизму при кислотном гидролизе оксиранов циклоалкенов получают циклоалкан-1,2-диолы транс-конфигурации. Раскрытие кольца окиси циклогексена происходит с образованием транс-диаксиального соединения.
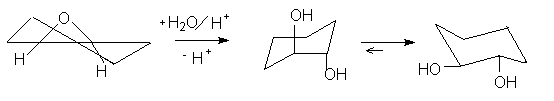
Методика.
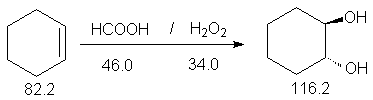
Константы исходных и синтезированных соединений. Приведены формула, т.пл.оС, т.кип.оС, d420 :
циклогексен ,-103.5, 83.3, 0.81 ;
HCOOH, 8.4, 101.0, 1.22 ;
NaOH, 319, 1390.0 ;
CH3COOC2H5, -84.0, 77.1, 0.90 ;
транс-циклогексан-1,2-диол,105.
Проведение синтеза.
В трехгорлую колбу (250 мл), снабженную обратным холодильником, капельной воронкой, термометром и магнитной мешалкой (прибор 4), помещают 61.0 г (1.30 моля) муравьиной кислоты и 5.70 г (0.05 моля) 30 %-ной перекиси водорода. Добавляют по каплям в течение 5 минут 4.1 г (0.05 моля) циклогексена ,при этом происходит повышение температуры до 60-70оС. Перемешивают реакционную смесь при этой температуре в течение двух часов до отрицательной пробы на перекись водорода. Проба на присутствие перекиси (KI + крахмал), при положительной пробе наблюдается синее окрашивание (почему ?). В случае слабого окрашивания реакционной смеси добавляют немного гидросульфита натрия и нагревают 10-15 минут до полного обесцвечивания. Затем воду и муравьиную кислоту отгоняют в вакууме, а остаток охлаждают ледяной водой и добавляют охлажденный до 0оС раствор 5 г гидроксида натрия в 10 мл воды с такой скоростью, чтобы температура не превышала 40оС. Продолжают перемешивание при 40оС еще 30 минут.
Обработка реакционной смеси.
Экстрагируют этилацетатом порциями по (5х50 мл). Обьединенные органические вытяжки промывают насыщенным раствором хлорида натрия и сушат сульфатом магния. Раствор упаривают в вакууме, после чего остаток закристаллизовывается.
Очистка.
Перекристаллизовывают из этилацетата и получают 2.80 г(48 %) транс-1,2-циклогександиола с т.пл. 105оС.
Примечание:~300 мл этилацетата могут быть собраны и очищены перегонкой.
Отходы (безвредные):~100 мл разбавленной муравьиной кислоты, 100 мл водной фазы и промывных вод.
Отходы, подлежащие утилизации: осушитель, фильтр.