![]()
ВВЕДЕНИЕ
В настоящей разработке для студентов III курса подобран ряд синтезов по основным разделам органической химии. Приведены как уже хорошо известные, так и современные, неизвестные ранее в практикуме органической химии методики синтезов. Для выполнения приведенных синтезов не требуется какой-либо специальной аппаратуры, труднодоступных и дорогостоящих реактивов, длительного нагревания и перемешивания.Перед каждым разделом приведено короткое теоретическое резюме по используемой в синтезе реакции (механизм, реагенты, побочные реакции).
В отличие от иных разработок подчеркивается, что синтез соединения состоит из трех частей : проведение синтеза, обработка реакционной смеси, выделение (очистка) целевого продукта. Для каждого синтеза указан рисунок прибора для его проведения и операции по обработке реакционной смеси и очистке полученного соединения (расшифровку см. в методической разработке " Техника эксперимента в органической химии " , С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин, 1998 г.).
В разработке уделяется внимание вопросам экологии – в конце методики указано, какие растворители и исходные соединения могут быть вновь очищены и повторно использованы в синтезе (регенерированы) (экономия реактивов, не загрязнение ими окружающей среды), какие отходы реакции являются безвредными(могут быть выброшены), а какие требуют предварительного обезвреживания.
В методиках приведены также основные константы исходных и конечных соединений.
В конце разработки приведены методики по очистке и абсолютированию наиболее часто используемых растворителей и реагентов.
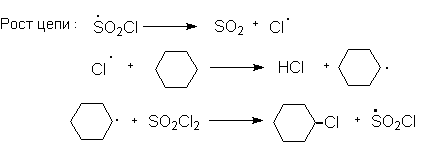
Хлорирование алканов элементарным хлором происходит под действием тепловой энергии или облучения (фотолиз),а также в присутствии инициаторов радикальных реакций: азобис(изобутиронитрила) (АИБН) или бензоилпероксида. Препаративно более удобным методом является хлорирование с помощью хлористого сульфурила. Сульфурилхлорид обладает большей избирательностью по сравнению с хлором, его проще дозировать, а побочными продуктами реакции являются газообразные вещества.
![]()
1.1 Хлорциклогексан.
![]()
Реакция циклогексана с сульфурилхлоридом протекает по свободнорадикальному механизму в присутствии инициатора (АИБН).
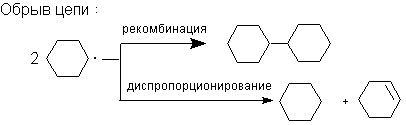

Методика.
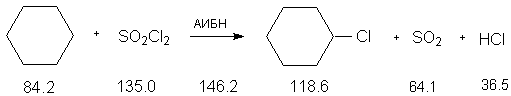
Константы исходных и синтезированных соединений. Приведены формула или название соединения, т. пл.о С, т.кип.о С при 760 мм рт. ст.).
Циклогексан, 6.5, 80.8, d420 0.7786 ;
SO2Cl2 ,-54.0, 70.0 ;
Na2CO3 , 854,1600 ;
SO2 ,-76.0, -10.0 ;
HCl, -114.8, 85.03 ;
хлорциклогексан, -43.0, 142.0, d420
0.9891, nD20 1.4626.
Проведение синтеза.
В одногорлую взвешенную колбу (250 мл) с эффективным обратным холодильником и магнитной мешалкой (прибор 1) помещают 20.2 г (0.24 моля) циклогексана, 27.0 г (0.2 моля) сульфурилхлорида и 75 мг (на кончике шпателя) азобис(изобутиронитрила). Синтез проводят под тягой (выделение SO2, HCl !). Сульфурилхлорид обладает слезоточивым действием. Образующиеся газы поглощают пропусканием их через промывную склянку, заполненную водным раствором гидроксида калия. Реакционную смесь нагревают при перемешивании до легкого кипения. Через 1 час колбу с содержимым взвешивают. Теоретическая потеря веса составляет 20.1 г. Если уменьшения веса не произошло, добавляют на кончике шпателя новую порцию АИБН и нагревают в течение 1 часа.
Обработка реакционной смеси.
Колбу охлаждают, реакционную смесь переносят в делительную воронку, добавляют 25 мл охлажденного до ОоС 10 %-ного раствора хлорида натрия. Органическую фазу отделяют и промывают в делительной воронке 5 % -ным раствором карбоната натрия до тех пор, пока водная фаза не станет нейтральной ( рН 7). Затем промывают органическую фазу насыщенным раствором хлорида натрия и сушат сульфатом магния.
Выделение.
Отделяют осушитель и раствор перегоняют, используя небольшой дефлегматор. Собирают первую фракцию с т.кип. 80-135 о С, которая содержит,в основном, непрореагировавший циклогексан (примечание 1). Далее перегоняется хлорциклогексан при температуре кипения 141-142 о С. Получают 14.2 г (60 %), nD20 1.4626.
Примечание : Непрореагировавший циклогексан (около 10 мл) очищают перегонкой с эффективным дефлегматором и используют для повторного хлорирования.
Методы обработки реакционной смеси : 2.1 ; 2.2 ; прибор 10A .
Выделение полученных соединений : 3.4 (прибор 13).
Отходы безвредные, сбрасывают в канализацию : ~ 200 мл промывных вод (Na2CO3, NaCl). Отходы подлежащие утилизации : 25 мл водного раствора кислоты, использованный осушитель (MgSO4), кубовый остаток после перегонки, ~ 100 мл водного раствора щелочи.
2.1. 1-Бромпропан.
Образование галоидных алкилов из первичных спиртов при действии на них концентрированных галоидоводородных кислот протекает в присутствии концентрированной серной кислоты и нагревании при высокой температуре. В этих условиях вторичные и третичные спирты обычно подвергаются также элиминированию (отщепление воды) и дают алкены (дегидратация в присутствии кислот является побочной реакцией). Реакция нуклеофильного замещения с образованием конечного продукта 1-бромпропана протекает как двухстадийный процесс : протонирование спирта и последующая замена гидроксильной группы на бром (SN2 механизм).
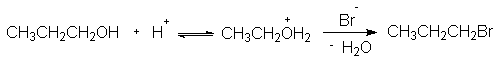
Методика.
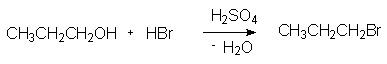 |
|||
60.1 |
80.9 |
98.1 |
123.0 |
Константы исходных и синтезированных соединений. Приведены : формула, т.пл., т.кип. о С при 760 мм рт. ст.
CH3CH2CH2OH, -126.0, 97.5, d420
0.8035 ;
HBr (>40 %),124;
H2SO4 (>15%) 10.3,338.0 ;
HCl (>25%),110 ;
CH3CH2CH2Br,-110.0,71.0, d420
1.3537, nD20 1.4343.
Проведение синтеза.
В двух- или трехгорлую колбу, снабженную магнитной мешалкой, капельной воронкой и длинным дефлегматором (40 см) с холодильником, алонжем и приемником, помещают 12.0 г (0.2 моля) пропанола-1. При охлаждении холодной водой прибавляют по каплям 9.8 г(0.1 моля) конц. серной кислоты (Осторожно !) и 50.6 г(0.3 моля 35 мл) 48%-ной бромистоводородной кислоты. Реакционную смесь нагревают до кипения и отгоняют образующийся пропилбромид (скорость отгонки 1 капля в секунду).
Обработка реакционной смеси.
Дистиллат два раза встряхивают с конц. серной кислотой, взятой в количестве 1/5 обьема отогнанного бромида, для удаления побочно образующегося дипропилового эфира (Внимание! Может образоваться стойкая эмульсия! ) Органический слой последовательно промывают водой, раствором бикарбоната натрия и снова водой. Высушивают прокаленным хлоридом кальция.
Выделение.
Осушитель отделяют декантацией или фильтрованием, а фильтрат перегоняют с длинным дефлегматором при атмосферном давлении, собирая фракцию с т.кип. 71оС. Получают 19.7 г(80 %) пропилбромида.
Методы обработки реакционной смеси : 2.1 ; 2.2 ; прибор 10A
Выделение целевого продукта : 3.4 (прибор 13).
Отходы (безвредные): ~ 100 мл промывных вод (NaHCO3), сбрасывают в канализацию. Отходы, подлежащие обезвреживанию (утилизации):~50 мл сильно кислого водного остатка и ~10 мл конц. серной кислоты, бумажный фильтр, использованный осушитель (хлористый кальций),предгон и остаток после перегонки 1-бромпропана.
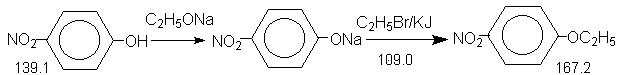
2.2. 4-Нитрофенетол.
Алкилариловые эфиры синтезируют по методу Вильямсона – алкилирование фенолов галогеналканами или алкилсульфонатами в присутствии оснований.
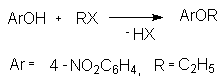
В предложенной методике из 4-нитрофенола при действии этилата натрия получают соответствующий фенолят натрия. Последний реагирует с алкилирующим агентом по SN2 механизму. По своей нуклеофильной силе и,соответственно, основности, 4-нитрофенолят натрия находится между фенолятом и ацетатом:
C2H5O - > OH - > PhO - > CH3OCO - > H2O > NO3 -
Добавление иодида калия к реакционной смеси приводит к промежуточному образованию этилиодида, более активному алкилирующему агенту по сравнению с этилбромидом ( анион иода - лучшая уходящая группа).
![]()
Методика.
Константы исходных и синтезированных соединений. Приведены формула, т.пл. о С, т.кип. о С при 760 мм рт.ст.
Пара-нитрофенол,113.0, 279.0 ;
C2H5Br, -119.0, 38.0, d420 1.4604
;
Na, 97.8, 882.9 ;
C2H5OH, -117.0, 78.4, d420
0.7893 ;
C2H5OC2H5, -116.0, 34.5, d420
0.7138 ;
NaOH, 319.0, 1390.0 ;
4-нитрофенетол 61.0.
Проведение синтеза.
В трехгорлую колбу (250 мл), снабженную обратным холодильником с хлоркальциевой трубкой и механической мешалкой (прибор 3), помещают 150 мл абсолютного этанола и порциями добавляют 2.88 г (0.125 моля) натрия. После растворения натрия реакционную смесь охлаждают (вода + лед) и прибавляют 13.9 г(0.1 моля) 4-нитрофенола, 43.6 г(0.4 моля, 27 мл) этилбромида (Oсторожно, раздражает кожу !) и около 0.5 г иодида калия. Образующуюся суспензию нагревают при интенсивном перемешивании в течение 4-х часов, при этом наблюдают выделение кристаллического бромида натрия и изменение окраски от оранжевой до желтой.
Обработка реакционной смеси.
После охлаждения осадок отделяют фильтрованием, промывают дважды этанолом (2 х 100 мл). Растворитель отгоняют на роторном испарителе. Остаток выливают в смесь, состоящую из 200 мл 2 %-го раствора гидроксида натрия и 200 мл диэтилового эфира. Перемешивают 10 минут, непрореагировавший 4-нитрофенолят натрия растворяется в водной фазе, а продукт в органическом слое. В делительной воронке отделяют органическую фазу, водный слой экстрагируют эфиром (2 х 50 мл) и обьединенные эфирные вытяжки высушивают прокаленным сульфатом магния. Осушитель отфильтровывают, растворитель удаляют на роторном испарителе.
Очистка.
Полученный твердый продукт перекристаллизовывают из смеси этанол-вода (5:1). Выделяют светло-желтые кристаллы, т.пл. 60-61 о С. Выход 12.2 г (73 %).
Методы обработки реакционной смеси : 3.2, прибор 10, 2.3, 2.1, 2.2, 3.1.
Примечание :~350 мл этанола, ~ 300 мл диэтилового эфира и маточный раствор водного этанола могут быть очищены перегонкой и вновь использованы.
Отходы подлежащие утилизации(обезвреживанию): бромид натрия,~200 мл щелочной водной фазы, использованный осушитель–сульфат магния, бумажный фильтр.
2.3. Дибензилсульфид.
Общим методом получения тиоэфиров является S-алкилирование тиолов (меркаптанов) аналогично синтезу простых эфиров по Вильямсону. Самым простым методом получения симметричных тиоэфиров является последовательное двухступенчатое алкилирование неорганических сульфидов галогеналканами или алкилсульфонатами, протекающее через стадию образования тиолатов (меркаптидов).
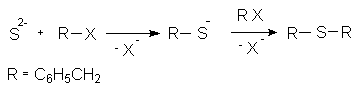
Реакция с бензилхлоридом протекает, вероятно, по SN1 механизму, которому благоприятствует как строение углеводородного радикала R (образование стабильного карбениевого иона), так и условия проведения реакции.
Методика.
126.6 |
240.2 | 214.3 |
Константы исходных и синтезированных
соединений. Приведены : формула или название
соединения, т.пл.о С, т.кип. о С, d 420.
C6H5CH2Cl, -41.0, 179.0, 1.1002 ;
Na2S.9H2O, 920.0 ;
CH3OH,-94.0,64.96, 0.7914 ;
(C6H5CH2)2S, 47.
Проведение синтеза.
В трехгорлой колбе (250 мл), снабженной обратным холодильником, механической мешалкой и капельной воронкой (прибор 3) растворяют 18.0 г(0.075 моля) девятиводного сульфида натрия в 15 мл воды. Добавляют 5 мл метанола и затем прибавляют по каплям при перемешивании 12.7 г(0.1 моля) бензилхлорида. Реакционную смесь нагревают в течение двух часов( синтез проводят под тягой).
Обработка реационной смеси.
После охлаждения содержимое колбы выливают при энергичном перемешивании в 70 мл ледяной воды. Выпавшие кристаллы отделяют фильтрованием, промывают водой и высушивают в вакуум-эксикаторе. Выделяют 10.3 г(96 %) сульфида в виде бесцветных кристаллов ,т. пл. 47оС. Полученный продукт может быть окислен далее до сульфона.
Методы обработки реакционной смеси : 3.2, прибор 10 Б,2.2.
Отходы, подлежащие утилизации(обезвреживанию):~ 100 мл маточного раствора и промывных вод.
2.4. Нитрометан.
Нитрометан получают взаимодействием нитрита
натрия с натриевой солью хлоруксусной кислоты. В
условиях реакции SN2 амбидентный
нитрит-анион атакует положительно
поляризованный ![]() - атом углерода хлоруксусной
кислоты центром наибольшей нуклеофильности –
атомом азота. Натриевая соль нитроуксусной
кислоты или свободная кислота согласно
уравнению (2) после термического
декарбоксилирования образует нитрометан.
- атом углерода хлоруксусной
кислоты центром наибольшей нуклеофильности –
атомом азота. Натриевая соль нитроуксусной
кислоты или свободная кислота согласно
уравнению (2) после термического
декарбоксилирования образует нитрометан.
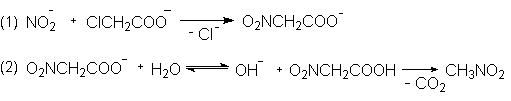
Если реакция нитрит-иона с хлоруксусной кислотой протекает по SN1 механизму, то NO2- группа взаимодействует центром наибольшей основности, которым является атом кислорода (уравнение 3). В результате образуется эфир азотистой кислоты, который гидролизуется далее до гликолевой кислоты.
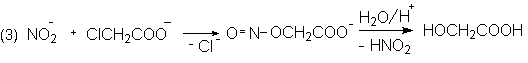
При алкилировании амбидентного аниона ионы серебра (и другие кислоты Льюиса) благоприятствуют протеканию реакции по атому кислорода – месту с наибольшей электронной плотностью. Так взаимодействие нитрита серебра с галогеналканами приводит к преимущественному образованию эфиров азотистой кислоты, в то время как с нитритом натрия получаются главным образом нитросоединения.
Методика.
94.5 |
69.0 |
61.0 |
58.4 |
44.0 |
|
Константы исходных и синтезированных соединений. Приведены: формула, т.пл. оС,т.кип. о С.
ClCH2COOH, 61.0, 189.0 ;
Na2CO3, 854.0, 1600.0 ;
NaNO2, 282.0 ;
CH3NO2 , -29.2, 101.0, d420
1.1382, nD20 1.3827.
Проведение синтеза.
В стакане растворяют 49.1 г(0.52 моля) хлоруксусной кислоты в 100 мл воды и нейтрализуют ее 27.5 г безводной соды (осторожно, пена !). После этого прибавляют раствор 34.5 г (0.5 моля) нитрита натрия в 60 мл воды. Примерно 50 мл полученного раствора помещают в круглодонную колбу (250 мл), снабженную капельной воронкой и насадкой Кляйзена с прямым холодильником (прибор 9Б). Колбу нагревают на асбестовой сетке до кипения, при этом начинается выделение углекислого газа, а образующийся нитрометан отгоняется с водой. Постепенно прибавляют из капельной воронки оставшийся раствор с такой скоростью, чтобы реакция не протекала слишком бурно. Перегонку ведут до тех пор, пока в дистиллате не перестанут появляться маслянистые капли. Образующийся нитрометан собирается в приемнике в виде тяжелого масла (верхний слой водный). Когда пойдет прозрачный отгон, меняют приемник и отгоняют еще 50 мл воды. От первой порции дистиллата отделяют слой нитрометана, а водный слой соединяют со второй порцией. Обьединенные водные растворы насыщают хлоридом натрия (10 г соли на каждые 30 мл раствора) и возвращают в реакционную колбу. Еще раз отгоняют примерно ј часть(по обьему) этого раствора. Полученный слой нитрометана обьединяют с первой порцией.
Очистка.
Обьединенные нитрометановые вытяжки сушат прокаленным хлоридом кальция и перегоняют, собирая фракцию с т.кип. 98-101о С. Выход 10.1 г(33 %).
Методы обработки реакционной смеси : 2.2. Очистка 3.4.
Отходы (безвредные) : ~ 50 мл водного остатка после перегонки, использованный осушитель(CaCl2), бумажный фильтр, предгон и остаток после перегонки нитрометана.