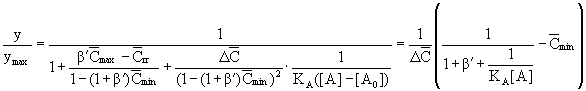|
[На
предыдущую главу]
Получение
параметров уравнений двуцентровой модели
рецептора
на основе
экспериментальных кривых “доза–эффект”
В качестве примера
применимости полученных уравнений абсолютного,
полного, частичного агонизма и антагонизма
рассмотрим результаты экспериментов Стефенсона
[8], исследовавшего сокращение
гладких мышц подвздошной кишки морской
свинки под действием ионов алкилтриметиламмония
(алкил-ТМА): CH3–(CH2)n–1–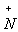 (CH3)3
, – см. таблицу. Их взаимодействие
с М-холинорецепторами мембран
мышечных клеток происходит за счет структурного
сходства с физиологическим медиатором
– ацетилхолином: CH3–С(O)–(CH2)2– (CH3)3
, – см. таблицу. Их взаимодействие
с М-холинорецепторами мембран
мышечных клеток происходит за счет структурного
сходства с физиологическим медиатором
– ацетилхолином: CH3–С(O)–(CH2)2–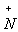 (CH3)3
. Стефенсон
нашел, что в этой серии соединений с ростом
длины алкильного заместителя n
наблюдается переход от полных (n
= 2ё6) к частичным
(n = 7ё9)
агонистам. (CH3)3
. Стефенсон
нашел, что в этой серии соединений с ростом
длины алкильного заместителя n
наблюдается переход от полных (n
= 2ё6) к частичным
(n = 7ё9)
агонистам.
Результаты обработки
экспериментальных данных в соответствии
с уравнениями двуцентровой модели (11–15)
приведены в таблице. Основное
теоретическое уравнение двуцентровой
модели (11–13) аппроксимируется
экспериментальными зависимостями вида:
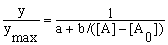 , (26)
, (26)
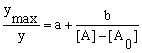 . (27)
. (27)
Уравнения имеют
четыре параметра: a
– отрезок, отсекаемый прямой на оси ординат
(обратные координаты); b
– тангенс угла наклона прямой; [A0]
– пороговая концентрация агониста; [A]max
– максимальная концентрация агониста.
Последняя входит в уравнения в неявном
виде и определяется либо непосредственно
из кривых “доза–эффект” как концентрация,
соответствующая y/ymax
= 1, либо исходя
из величин a и b:
[A]max = [A0] + b/(1 –
a) , при a
< 1 . (28)
Дополнительный
параметр – коэффициент максимальной активации
a* получается
из соотношения (18a): a*
= y'max /ymax
, либо из (22): a* = 1/a.
Определять параметры
a, b, [A0]
проще всего по уравнению (27),
так как параметры этой линейной зависимости
легко рассчитываются либо графически либо
методом наименьших квадратов [9].
Можно использовать и компьютерные вычисления,
применяя программу MATHCAD
8.0. Тогда методом
наименьших квадратов сразу получаются
параметры кривой “доза–эффект” (26).
Полученные таким
образом значения a, b, [A0],
[A]max приведены
в таблице и позволяют вычислить
параметры теоретических уравнений (11–13): 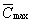 , , 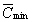 , , 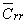 ,
b , b ', KA
и K'A, исходя
из системы уравнений: ,
b , b ', KA
и K'A, исходя
из системы уравнений:
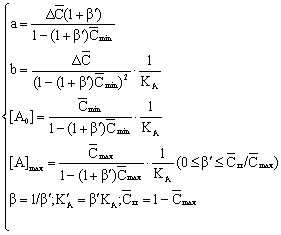 (29)
(29)
Определить значения 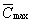 , , 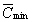 ,
b ', KA
с помощью системы (29)
можно только численно, используя первые
ее четыре уравнения и компьютерную программу
MATHCAD 8.
Величины b
, K'A и ,
b ', KA
с помощью системы (29)
можно только численно, используя первые
ее четыре уравнения и компьютерную программу
MATHCAD 8.
Величины b
, K'A и 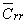 вычисляются с помощью последних трех уравнений
из (29). Таким способом характеристики взаимодействия
вещества с рецептором определяются только
для абсолютных и полных агонистов. Для
частичных агонистов подобные вычисления
провести невозможно, так как отсутствует
уравнение для максимальной концентрации
агониста. В этом случае
можно воспользоваться приближенным решением,
учитывая, что для абсолютных агонистов
b '
@ 0. За абсолютный
агонист c величиной
b '
= 0 можно взять агонист с
наименьшим значением b
' (или с максимальным b
). Им является этил-ТМА, имеющий минимальное
значение a из всей серии исследованных
ионов и, согласно первому уравнению системы
(29), минимальное b
' = 0,0049, определенное
первым способом. Тогда система (29) сводится
к уравнениям (1) для абсолютных агонистов,
что позволяет для этил-ТМА определить
величины
вычисляются с помощью последних трех уравнений
из (29). Таким способом характеристики взаимодействия
вещества с рецептором определяются только
для абсолютных и полных агонистов. Для
частичных агонистов подобные вычисления
провести невозможно, так как отсутствует
уравнение для максимальной концентрации
агониста. В этом случае
можно воспользоваться приближенным решением,
учитывая, что для абсолютных агонистов
b '
@ 0. За абсолютный
агонист c величиной
b '
= 0 можно взять агонист с
наименьшим значением b
' (или с максимальным b
). Им является этил-ТМА, имеющий минимальное
значение a из всей серии исследованных
ионов и, согласно первому уравнению системы
(29), минимальное b
' = 0,0049, определенное
первым способом. Тогда система (29) сводится
к уравнениям (1) для абсолютных агонистов,
что позволяет для этил-ТМА определить
величины 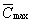 , , 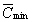 , , 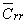 ,
KA и K'A.
Первые три являются параметрами уравнений
связи, в опытах на одном и том же объекте
их приближенно можно считать
постоянными величинами, одинаковыми для
всей серии от этил- до нонил-ТМА: ,
KA и K'A.
Первые три являются параметрами уравнений
связи, в опытах на одном и том же объекте
их приближенно можно считать
постоянными величинами, одинаковыми для
всей серии от этил- до нонил-ТМА: 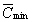 = 0,046,
= 0,046, 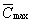 = 0,83,
= 0,83, 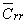 = 0,17. Отсюда величины b
и b ' для
остальных соединений можно определить
из первого уравнения системы (29):
= 0,17. Отсюда величины b
и b ' для
остальных соединений можно определить
из первого уравнения системы (29):
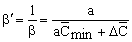 .
(30) .
(30)
Константы равновесия
KA и K'A
вычисляются из второго уравнения системы
(29) с помощью уже известных величин b
':
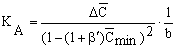 ;
K'A = KA b
' . (31) ;
K'A = KA b
' . (31)
Существует и третий
способ определения величин 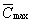 , , 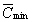 , , 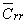 ,
b , b ', KA
и K'A, когда
используется эквивалентная форма уравнения
двуцентровой модели: ,
b , b ', KA
и K'A, когда
используется эквивалентная форма уравнения
двуцентровой модели:
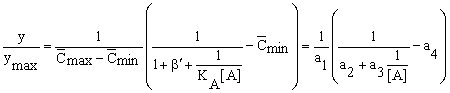 , при [A] і [A0],
(32)
, при [A] і [A0],
(32)
полученная из
основного уравнения (11, 12)
подстановкой в него выражения (14)
для начальной концентрации агониста [A0].
Коэффициенты a1, a2, a3
и a4 вычисляются
методом наименьших квадратов, что
дает возможность определить величины 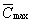 , , 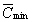 , , 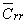 ,
b , b ', KA
и K'A: ,
b , b ', KA
и K'A:
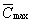 = a1 + a4,
= a1 + a4, 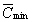 = a4, b = 1/(a2
– 1), b ' = a2
– 1,
= a4, b = 1/(a2
– 1), b ' = a2
– 1,
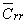 = 1 – a1 – a4, KA
= 1/a3 , K'A = (a2
– 1)/a3.
(33)
= 1 – a1 – a4, KA
= 1/a3 , K'A = (a2
– 1)/a3.
(33)
С помощью уравнений
(33) можно определять параметры взаимодействия
вещества с рецептором как для полных, так
и для частичных агонистов. Определение
величин относительного сродства b
', близких к нулю, затруднено,
так как при этом коэффициент a2
мало отличается от 1. Поэтому оптимальным
является сочетание первого и третьего
способов: параметры уравнений для абсолютных
и полных агонистов определяются по системе
(29), а частичных – по системе (33).
Полученные таким
образом величины 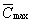 , , 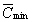 , , 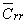 ,
b , b ', KA
и K'A для серии
ионов алкил-ТМА приведены в таблице.
С их помощью можно построить теоретические
зависимости “доза–эффект” (11, 12)
и сравнить их с экспериментальными (рис.
4А). ,
b , b ', KA
и K'A для серии
ионов алкил-ТМА приведены в таблице.
С их помощью можно построить теоретические
зависимости “доза–эффект” (11, 12)
и сравнить их с экспериментальными (рис.
4А).
Как видно из рис.
4, экспериментальные точки очень хорошо
ложатся на теоретические кривые. Преобразование
в обратных координатах дает прямые линии,
последовательно поднимающиеся вверх по
оси ординат (рис. 4B,
C); их объединение на одном
графике достигается выбором координаты
1/[A] вместо 1/([A]
– [A0]).
Прямолинейность сохраняется для [A]
>> [A0].
Анализ полученных
данных показывает, что наблюдаемый в ряду
ионов алкилтриметиламмония переход от
абсолютных (этил-ТМА) к полным (бутил-,
гексил-ТМА) и частичным (гептил-, октил-
и нонил-ТМА) агонистам сопровождается,
в соответствии с теорией, падением величины
относительного сродства к активному и,
параллельно с этим, увеличением сродства
к неактивному центрам рецептора (таблица
и рис. 5).
Границей перехода,
как это следует из неравенств (17), является
величина b
' = 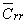 / /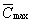 = 0,19ё0,27, определяемая резервом
и максимальной концентрацией рецепторов,
что и подтверждается в эксперименте (таблица).
При этом у частичных агонистов величина
коэффициента максимальной активации становится
меньше 1. Значений b
' і (1/
= 0,19ё0,27, определяемая резервом
и максимальной концентрацией рецепторов,
что и подтверждается в эксперименте (таблица).
При этом у частичных агонистов величина
коэффициента максимальной активации становится
меньше 1. Значений b
' і (1/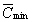 )
– 1, соответствующих переходу
к полным антагонистам, в этой серии соединений
не наблюдается. )
– 1, соответствующих переходу
к полным антагонистам, в этой серии соединений
не наблюдается.
Константа равновесия
реакции взаимодействия с неактивным центром
K'A увеличивается
с увеличением длины алкильного радикала,
в то время как аналогичная константа равновесия
с активным центром, пройдя через максимум
при n = 3ё4,
уменьшается (рис. 6). Наличие
максимума соответствует значениям n,
при которых достигается наибольшее структурное
сходство с физиологическим агонистом –
ацетилхолином.
Следовательно,
имеется явная связь между параметрами
реакции взаимодействия ионов алкил-ТМА
с активным и неактивным центрами рецептора
и длиной неполярного алкильного радикала
в их молекуле. Найденную закономерность
можно объяснить, исходя из представлений
об активном центре как преимущественно
гидрофильной, а о неактивном центре – как
гидрофобной областях рецептора [2, 3].
Увеличение длины неполярного алкильного
радикала приводит к усилению гидрофобных
свойств в молекуле алкил-ТМА, в результате
чего тормозится его взаимодействие с полярными
группами активного центра, но усиливается
сродство к гидрофобной неактивной области.
Таким образом,
в рамках двуцентровой модели тип взаимодействия
физиологически активного соединения A
с рецептором определяется величинами относительного
сродства b
и b ',
соответственно, к активному и неактивному
центрам рецептора и их соотношением с параметрами
уравнений связи – 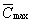 , , 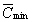 , , 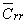 ,
что можно изобразить в виде схемы: ,
что можно изобразить в виде схемы:
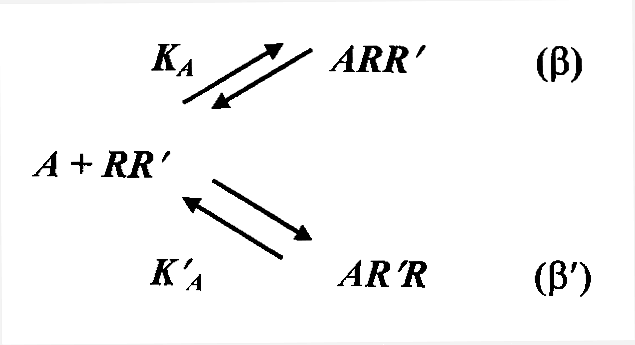
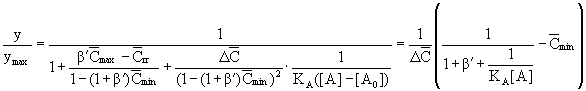
|
Тип взаимодействия
|
b = KA/K'A
|
b ' = K'A/KA
|
| Абсолютный
агонизм |
Ґ
|
0
|
| Полный
агонизм |
 / / Ј b < Ґ
Ј b < Ґ
|
0 < b ' Ј  / /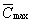
|
Частичный
агонизм
(частичный антагонизм) |
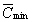 /(1– /(1–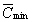 )<b
< )<b
<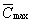 / /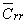
|
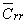 / /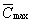 <b
'<(1/ <b
'<(1/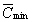 )–1 )–1
|
| Полный
антагонизм |
0 Ј b Ј 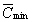 /(1
– /(1
– 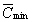 ) )
|
(1/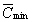 )
– 1 Ј b ' Ј Ґ )
– 1 Ј b ' Ј Ґ
|
Таким образом,
в ряду производных алкилтриметиламмония
наблюдается переход от полных агонистов
рецепторов ацетилхолина к полным антагонистам
через промежуточный ряд частичных агонистов,
что соответствует изменению фармакологических
свойств от холинергических до холинолитических.
Молекулярный механизм данного явления
связан как со структурой рецептора, так
и со структурой взаимодействующего с ним
фармакологически активного соединения.
Изменение направленности фармакологического
эффекта определяется сложным строением
рецептора, имеющего в своем составе два
центра взаимодействия с гидрофильными
и гидрофобными свойствами. При изменении
структуры молекулы в сторону усиления
гидрофобных свойств имеет место взаимодействие
преимущественно с гидрофобным центром
рецептора. И наоборот, при усилении гидрофильных
свойств – с гидрофильным центром, что сопровождается
изменением фармакологического эффекта.
В этом и заключается молекулярный механизм
изменения направленности фармакологических
свойств в ряду производных алкилтриметиламмония.
Он служит классическим
примером связи физико-химических свойств
с фармакологической активностью химических
соединений.
[На
Список литературы] [На
Содержание]
Copyright ©
|


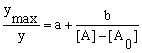 . (27)
. (27)
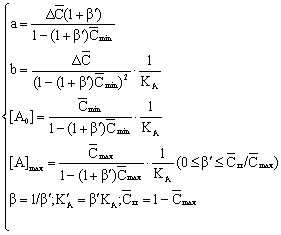 (29)
(29)
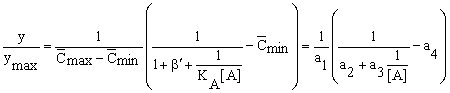 , при [A] і [A0],
(32)
, при [A] і [A0],
(32)