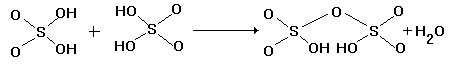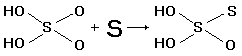|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[предыдущий раздел] [содержание] [следующий
раздел]
§ 13. Многообразие оксокислот серы (VI).
Серную кислоту H2SO4 правильнее
называть ортосерной кислотой, так как в ней
содержится наибольшее число гидроксильных
групп, связанных с одним атомом серы (VI). При
дегидратации H2SO4 или при насыщении
водного раствора серной кислоты триоксидом серы:
H2SO4 + SO3 = H2S2O7
два тетраэдра 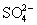 связываются общим атомом кислорода в вершине
тетраэдра в дисерную кислоту H2S2O7
(рис.9, направление I).
связываются общим атомом кислорода в вершине
тетраэдра в дисерную кислоту H2S2O7
(рис.9, направление I).
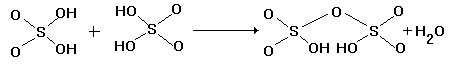
Известны олигомерные ионы (SnO3n+1)2-
, где n = 1,2,3,....
Большинство оксокислот серы (VI) генетически
удобно рассматривать как результат замещения
кислорода или гидроксильной группы на
изоэлектронные частицы.
При замещении в H2SO4 концевого атома
кислорода на атом серы (направление II на рис.9) и
атом селена образуется тиосерная кислота H2S2O3
и селеносерная H2SSeO3 кислота,
соответственно. В свою очередь, замещение
мостикового атома кислорода в дисерной кислоте
на один или цепочку атомов серы (путь III на рис.9)
возникает ряд политионовых кислот, а на
пероксидную группу - О- О- (путь IV на рис.9) - пероксодисерная
кислота. Гидроксильная группа - ОН в H2SO4
может заместиться на гидропероксогруппу - ООН
(путь V на рис.9) с образованием пероксомоносерной
кислоты, или кислоты Каро H2SO5, а
также на атом галогена или аминогруппу - NH2
(путь VI на рис.9) с образованием галогенсульфоновой
(Х = F, Cl) или сульфаминовой (NH2)(HO)SO2
кислот, соответственно.
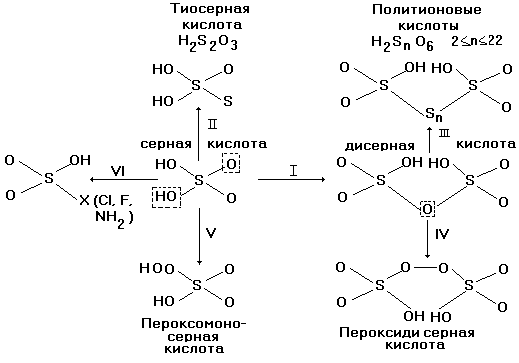
Рис.9. Схема оксокислот серы (VI).
Для наглядности упоминаемые выше наиболее
стабильные оксоанионы серы изображены в виде
геометрических фигур на рис.П.1 в приложении.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 13.1 Тиосерная кислота и тиосульфаты.
При кипячении раствора сульфита натрия с
порошком серы образуется тиосульфат натрия Na2S2O3:
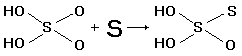
Свободная тиосерная кислота H2S2O3
в присутствии воды необратимо распадается по
упрощенной схеме: H2S2O3  H2SO3
+ S H2SO3
+ S  H2O + SO2+
S, поэтому выделить ее из водных растворов
невозможно. Свободная кислота получена при
низкотемпературном взаимодействии сероводорода
и хлорсульфоновой кислоты: HSO3Cl + H2S H2O + SO2+
S, поэтому выделить ее из водных растворов
невозможно. Свободная кислота получена при
низкотемпературном взаимодействии сероводорода
и хлорсульфоновой кислоты: HSO3Cl + H2S  H2S2O3
+ HCl. Ниже 0оС H2S2O3 количественно
распадается: 3H2S2O3 H2S2O3
+ HCl. Ниже 0оС H2S2O3 количественно
распадается: 3H2S2O3  3H2O + 2SO3 +
S (интересно сопоставить эту реакцию с распадом
серной кислоты H2SO4 3H2O + 2SO3 +
S (интересно сопоставить эту реакцию с распадом
серной кислоты H2SO4 H2O+SO3
выше ее температуры кипения). H2O+SO3
выше ее температуры кипения).
В отличие от кислоты ее устойчивые соли легко
образуются при взаимодействии растворов
сульфитов с H2S: 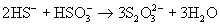 или при кипячении их растворов с серой* ):
или при кипячении их растворов с серой* ): 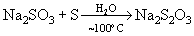 , а также при окислении
полисульфидов кислородом воздуха: CaS2+ 3/2 O2 , а также при окислении
полисульфидов кислородом воздуха: CaS2+ 3/2 O2
 CaS2O3
или Na2S5 + 3/2 O2 CaS2O3
или Na2S5 + 3/2 O2 Na2S2O3
+3S. Na2S2O3
+3S.
По строению ион тиосульфата близок к иону 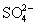 : тетраэдр [SO3S]
несколько искажен из-за большей длины связи S-S (1.97 : тетраэдр [SO3S]
несколько искажен из-за большей длины связи S-S (1.97 ) по сравнению со связью S-
O (1.48 ) по сравнению со связью S-
O (1.48 ). ).
В связи с наличием атомов серы в степени
окисления - 2 ион 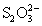 обладает восстановительными свойствами,
например, слабыми окислителями (I2, Fe3+)
тиосульфат окисляется до иона тетратионата:
2S2O32- + I2
обладает восстановительными свойствами,
например, слабыми окислителями (I2, Fe3+)
тиосульфат окисляется до иона тетратионата:
2S2O32- + I2  S4 O6 2-
+ 2I- , а более сильными окислителями - до иона
сульфата: S4 O6 2-
+ 2I- , а более сильными окислителями - до иона
сульфата: 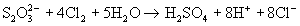 (в связи с
использованием в последней реакции ранее
тиосульфат называли "антихлором"). (в связи с
использованием в последней реакции ранее
тиосульфат называли "антихлором").
Сильными восстановителями ион 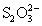 восстанавливается до производных
S(2-): восстанавливается до производных
S(2-):
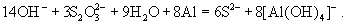
Тиосульфат-ион - сильный
комплексообразователь, использующийся в
фотографии для удаления из фотопленки
невосстановленного бромида серебра:
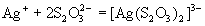 . .
Отметим, что металлами S2O32- ион
координируется через атом серы, поэтому
тиосульфатные комплексы легко превращаются в
соответствующие сульфиды, например,
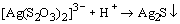 . .
[предыдущий раздел] [содержание] [следующий
раздел]
§ 13.2. Политионовые кислоты и их соли.
При замещении мостикового кислорода в дисерной
кислоте на один или цепочку атомов серы
возникают ди- , три- и другие политионовые
кислоты H2SnO6, где 2  n n  22 (рис.8, направление III). 22 (рис.8, направление III).
Благодаря возникновению связи S-S степень
окисления атомов серы в дитионовой кислоте HO3S-SO3H
считается пониженной до +5. Кислота в свободном
виде не выделена, однако обменным
взаимодействием Ba2S2O6 + H2SO4
 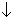 BaSO4 + H2S2O6
получены ее достаточно концентрированные
растворы. Соли, дитионаты, синтезируют
окислением водных растворов SO2 суспензиями
порошков оксидов марганца или железа (MnO2, Fe2O3):
MnO2 + 2 SO2 BaSO4 + H2S2O6
получены ее достаточно концентрированные
растворы. Соли, дитионаты, синтезируют
окислением водных растворов SO2 суспензиями
порошков оксидов марганца или железа (MnO2, Fe2O3):
MnO2 + 2 SO2 MnS2O6 .При n MnS2O6 .При n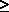 і 3 степень окисления серы в
политионовых кислотах H2SnO6
уменьшается ниже +4 і 3 степень окисления серы в
политионовых кислотах H2SnO6
уменьшается ниже +4 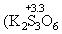 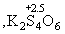 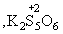 и
т.д.). Сложные политионаты, содержащие до 23 атомов
серы, получены из тиосульфатов с помощью SCl2
или S2Cl2, например, K2S2O3+
+S2Cl2 и
т.д.). Сложные политионаты, содержащие до 23 атомов
серы, получены из тиосульфатов с помощью SCl2
или S2Cl2, например, K2S2O3+
+S2Cl2 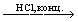 K2SnO6
+ 2KCl (3 K2SnO6
+ 2KCl (3 n n  22). Сера
благодаря способности к катенации и
разнообразию степеней окисления образует
множество оксокислот различной устойчивости.
Термодинамическую стабильность и взаимный
переход соединений серы с разной степенью
окисления удобно сопоставить с помощью диаграммы
окислительных состояний (рис.10). 22). Сера
благодаря способности к катенации и
разнообразию степеней окисления образует
множество оксокислот различной устойчивости.
Термодинамическую стабильность и взаимный
переход соединений серы с разной степенью
окисления удобно сопоставить с помощью диаграммы
окислительных состояний (рис.10).
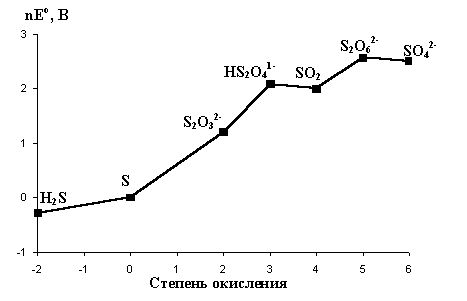
Рис.10. Диаграмма окислительных
состояний серы (рН=0).
Из этой диаграммы следует, что Н2S
термодинамически может восстанавливать все
оксокислоты до свободной серы. Кроме того,
поскольку вольтэквиваленты оксокислот
промежуточных степеней окисления лежат выше
линии, соединяющей вольтэквиваленты 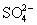 и S, то указанные
оксокислоты могут диспропорционировать на
серную кислоту и серу. Окислителями средней силы
их можно окислять до H2SO4, а сильными
восстановителями (Zn+H+, Al+OH-) -
восстановить до сероводорода или его солей. В
соответствии с диаграммой окислительных
состояний дитионаты сильными окислителями (KMnO4,
K2Cr2O7) окисляются до сульфатов: и S, то указанные
оксокислоты могут диспропорционировать на
серную кислоту и серу. Окислителями средней силы
их можно окислять до H2SO4, а сильными
восстановителями (Zn+H+, Al+OH-) -
восстановить до сероводорода или его солей. В
соответствии с диаграммой окислительных
состояний дитионаты сильными окислителями (KMnO4,
K2Cr2O7) окисляются до сульфатов: 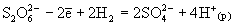 , а сильными
восстановителями (например, амальгама натрия,
Na/Hg) восстанавливаются до сульфитов и дитионитов , а сильными
восстановителями (например, амальгама натрия,
Na/Hg) восстанавливаются до сульфитов и дитионитов 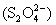 : : 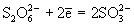 . .
[предыдущий раздел] [содержание] [следующий
раздел]
§ 13.3. Пероксиды и галогенсульфоновые
кислоты
При замене мостикового кислорода пиросерной
кислоты на перекисную группу -О-О- образуется пероксодисерная
кислота H2S2O8 (рис.9,
направление IV). Ее синтезируют электролизом
водного раствора H2SO4 : 2 H2SO4
+ 2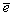  H2S2O8
+ 2Н+, а наиболее важные соли,
пероксодисульфаты (персульфаты) K2S2O8
и (NH4)2 S2O8, - анодным
окислением сульфатов: 2KHSO4 = K2S2O8
+ H2 . H2S2O8
+ 2Н+, а наиболее важные соли,
пероксодисульфаты (персульфаты) K2S2O8
и (NH4)2 S2O8, - анодным
окислением сульфатов: 2KHSO4 = K2S2O8
+ H2 .
Структура иона 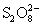 представляет
собой 2 тетраэдра SO4, соединенных между
собой пероксидной группой -О-О. Кислота
смешивается с водой в любых пропорциях. Реакция
взаимодействия с водой используется для
получения перекиси водорода: представляет
собой 2 тетраэдра SO4, соединенных между
собой пероксидной группой -О-О. Кислота
смешивается с водой в любых пропорциях. Реакция
взаимодействия с водой используется для
получения перекиси водорода:
H2S2O8 + 2 H2O 2H2SO4
+ H2O2. 2H2SO4
+ H2O2.
Соли пероксодисерной кислоты - сильнейшие
окислители:
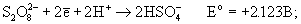

Ион 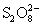 в присутствии
катализатора окисляет ион Mn2+
непосредственно в перманганат: в присутствии
катализатора окисляет ион Mn2+
непосредственно в перманганат: 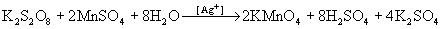 . .
При замене атома кислорода гидроксильной
группы в H2SO4 на перекисную группу
образуется пероксомоносерная кислота H2SO5
(рис.9, направление V). Безводную H2SO5 получают
при взаимодействии хлоросерной кислоты с
безводной перекисью водорода: HOOH + ClSO2(OH)  HOOSO2(OH) + HCl,
а также при действии концентрированной H2SO4
на пероксодисульфаты: HOOSO2(OH) + HCl,
а также при действии концентрированной H2SO4
на пероксодисульфаты: 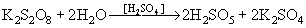 . Кислота H2SO5 является
одноосновной, так как атом Н пероксидной
группировки не диссоциирует. H2SO5
активно взаимодействует с водой: H2SO5+
H2O . Кислота H2SO5 является
одноосновной, так как атом Н пероксидной
группировки не диссоциирует. H2SO5
активно взаимодействует с водой: H2SO5+
H2O H2SO4
+ H2O2. В кристаллическом виде
взрывоопасна. Ее соли термически мало устойчивы
и при нагревании отщепляют кислород. При
замещении гидроксильной группы серной кислоты
на изоэлектронные группы F- , Cl- (рис.9, направление
VI) образуются соответственно фтор- (F(OH)SO2)
и хлорсульфоновая (Cl(OH)SO2) кислоты.
Практически их синтезируют взаимодействием
галогеноводородных кислот HF (HCl) с жидким SO3.
Фторсульфоновая кислота в отличие от
хлорсульфоновой практически не гидролизуется
водой. Введение фтора из-за усиления поляризации
связи О- Н приводит к повышению силы
фторсульфоновой кислоты. H2SO4
+ H2O2. В кристаллическом виде
взрывоопасна. Ее соли термически мало устойчивы
и при нагревании отщепляют кислород. При
замещении гидроксильной группы серной кислоты
на изоэлектронные группы F- , Cl- (рис.9, направление
VI) образуются соответственно фтор- (F(OH)SO2)
и хлорсульфоновая (Cl(OH)SO2) кислоты.
Практически их синтезируют взаимодействием
галогеноводородных кислот HF (HCl) с жидким SO3.
Фторсульфоновая кислота в отличие от
хлорсульфоновой практически не гидролизуется
водой. Введение фтора из-за усиления поляризации
связи О- Н приводит к повышению силы
фторсульфоновой кислоты.
[предыдущий раздел] [содержание] [следующий
раздел]
|