|
Учебные материалы по физической химии
Реальные газы
Глава 2. Статистическая термодинамика
классических реальных газов
2.1. Общие соотношения статистической
термодинамики
Из основных положений статистической механики
следует, что термодинамические свойства
классической системы, состоящей из N
одинаковых частиц и занимающей объем V при
температуре T, полностью определяются канонической
статистической суммой (статистическим
интегралом):
Z(T,V,N) = 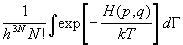 , (2.1) , (2.1)
где H(p,q) - классическая функция
Гамильтона системы, dГ = d3Np d3Nq
- элемент фазового объема (d3Np =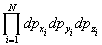 , d3Nq = , d3Nq =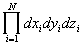 ), h - постоянная
Планка, k - постоянная Больцмана. Интеграл в
(2.1) имеет кратность 6N и размерность
(координатаґ импульс)3N. Сама
статистическая сумма безразмерна. ), h - постоянная
Планка, k - постоянная Больцмана. Интеграл в
(2.1) имеет кратность 6N и размерность
(координатаґ импульс)3N. Сама
статистическая сумма безразмерна.
Статистическая сумма содержит в себе всю
термодинамическую информацию о системе. Если
удалось теоретически рассчитать статистическую
сумму (как это сделать - отдельный вопрос), то
можно определить все термодинамические функции
и вывести термическое и калорическое уравнения
состояния. Так, свободная энергия Гельмгольца
связана со статистической суммой соотношением:
F = –kT ln Z . (2.2)
Энтропия и давление системы связаны с
производными статистической суммы по
температуре и объему, соответственно:
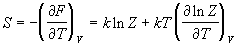 , (2.3) , (2.3)
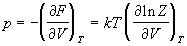 . (2.4) . (2.4)
Последнее соотношение дает давление как
функцию температуры и объема, т.е. термическое
уравнение состояния. Калорическое уравнение
состояния, т.е. зависимость внутренней энергии от
температуры и объема дается соотношением:
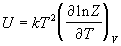 . (2.5) . (2.5)
Таким образом, основная задача классической
статистической термодинамики состоит в расчете
статистической суммы (2.1).
Формулы (2.2) – (2.5), выражающие связь между
термодинамикой и статистической механикой,
справедливы для любых термодинамических систем.
Формула (2.1) справедлива только для классических
систем, в которых квантовые эффекты
несущественны, в частности для систем, состоящих
из частиц, не имеющих внутренней структуры.
Многие такие системы (например, газы и жидкости)
описываются гамильтонианом вида
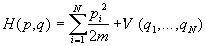 , (2.6) , (2.6)
где m - масса частиц, V - потенциальная
энергия их взаимодействия друг с другом. В
гамильтониане (2.6) координаты и импульсы
разделены, поэтому интегрирование по ним можно
провести независимо. Подставляя (2.6) в (2.1) и
вычисляя интегралы по N импульсам
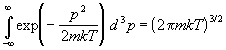 , ,
получаем статистическую сумму в виде
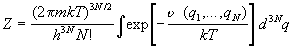 . (2.7) . (2.7)
Интеграл по координатам в формуле (2.7) называют конфигурационным
интегралом:
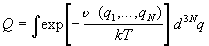 . (2.8) . (2.8)
Именно он определяет зависимость
статистической суммы от объема и содержит в себе
описание всех отклонений системы от идеального
поведения. Давление системы определяется только
конфигурационным интегралом:
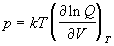 . (2.9) . (2.9)
2.2. Статистическая термодинамика
идеального одноатомного газа
Для идеального газа потенциал взаимодействия
частиц равен нулю. Кроме того, в этой модели
частицы не имеют собственного объема, поэтому
интегрирование по координатам проводится по
всему объему системы и конфигурационный
интеграл равен
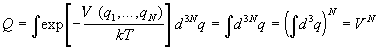 . .
Статистическая сумма имеет вид:
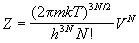 . (2.10) . (2.10)
Все термодинамические функции выражаются
через логарифм статистической суммы:
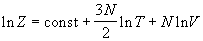 . (2.11) . (2.11)
Подставляя (2.11) в (2.4), находим термическое
уравнение состояния идеального одноатомного
газа (зависимость давления от температуры и
объема):
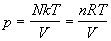 , ,
где n = N / NA - число молей, R = kЧ
NA - универсальная газовая постоянная. Калорическое
уравнение состояния (зависимость внутренней
энергии от температуры и объема) получается при
подстановке (2.11) в (2.5):
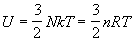 . .
Наконец, из (2.10) и (2.3) можно получить уравнение
Закура-Тетроде для энтропии одного моля
одноатомного идеального газа:
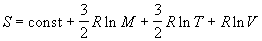 , ,
где M = mЧ NA - молярная масса газа.
Значение постоянной в этом уравнении зависит от
размерностей величин, стоящих под знаком
логарифма [4, с. 210].
Таким образом, на примере идеального газа мы
реализовали схему, демонстрирующую связь
микроскопических свойств (гамильтониана)
системы с ее макроскопическими (т.е.,
термодинамическими) свойствами:
| Гамильтониан |
(2.1)
|
Статистическая
сумма |
(2.2) – (2.5)
 |
Термодинамические функции, уравнение
состояния |
|

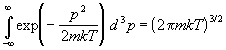 ,
,