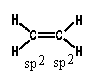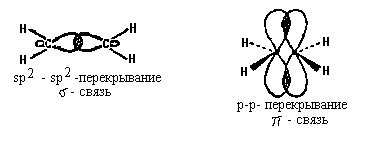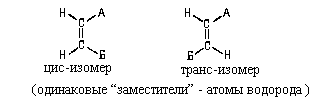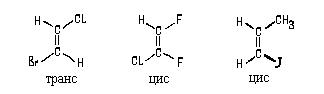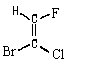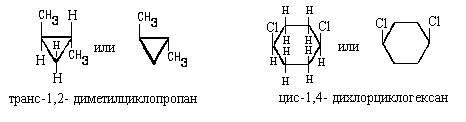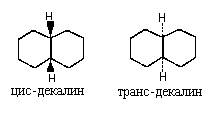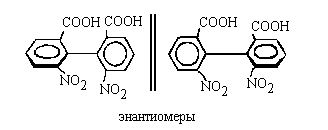|
Учебные материалы/ органическая химия
В.П.Дядченко "Введение в стереохимию"
IX. Стереоизомерия алкенов.
Атомы углерода молекулы этилена находятся в
sp2-гибридном состоянии:
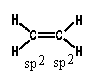
Двойную связь С -С можно рассматривать как
состоящую из  -связи (перекрывание
гибридных орбиталей атомов углерода) и -связи (перекрывание
гибридных орбиталей атомов углерода) и  -связи,
образованной боковым перекрыванием
р-орбиталей: -связи,
образованной боковым перекрыванием
р-орбиталей:
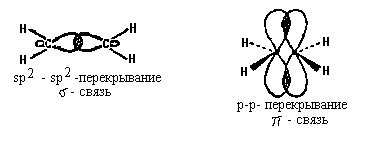
Поворот CН2- гpynn молекулы этилена друг
относительно друга должен привести к
нарушению перекрывания р-орбиталей, то-есть к
разрыву  -связи.
Энергетический барьер такого поворота по разным
оценкам, составляет 60-65 ккал/ моль и при обычных
условиях такой поворот не происходит (поворот возможен при фотохимическом
возбуждении молекулы) -связи.
Энергетический барьер такого поворота по разным
оценкам, составляет 60-65 ккал/ моль и при обычных
условиях такой поворот не происходит (поворот возможен при фотохимическом
возбуждении молекулы)
Сказанное в полной мере относится и к другим
молекулам с двойной связью С=С. Поэтому для
аляенов возможна стереоизомерия, обусловленная
различным взаимным расположением заместителей
при двойной связи:
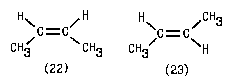
Стереоиозмеры (22) и (23) не являются зеркальными
антиподами. Согласно определению, приведенному
на стр. 42, изомеры (22) и (23) - это диастореомеры.
Иногда, с целью подчеркнуть причастность  -связи к
появлению этой изомерии, их называют -связи к
появлению этой изомерии, их называют  -диастереоизомерами
(раньше их называли геометрическими
изомерами) в отличие от -диастереоизомерами
(раньше их называли геометрическими
изомерами) в отличие от
 -диастереомеров, рассмотренных в
разделе VI. -диастереомеров, рассмотренных в
разделе VI.
Конечно, этот вид изомерии невозможен, если
хотя 6ы у одного из атомов углерода, образующих
двойную связь, два заместителя одинаковы:
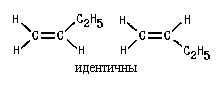
Для наименования  -диастереомеров широко
используется цис-транс-номенклатура. Ее
применяют в тех случаях, когда у разных
атомов углерода С = С-связи есть одинаковые
заместители. -диастереомеров широко
используется цис-транс-номенклатура. Ее
применяют в тех случаях, когда у разных
атомов углерода С = С-связи есть одинаковые
заместители.
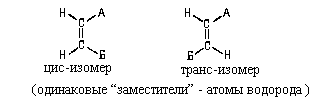
В сооветствии с этим, изомеры (22) и (23) следует
назвать цис-бутен-2 и транс-бутен-2. Аналогично
можно назвать приведенные ниже соединения.
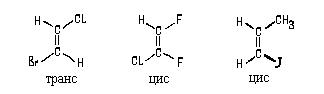
Но что делать, если все четыре заместителя при
двойной связи -разные? Какой, например, изомер
изображен ниже: цис- или транс-?
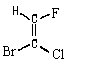
В таком случае надо выбрать старший
заместитель при одном атоме углерода, образующем
двойную связь, и старший заместитель при другом
атоме углерода. Сравнивая положение старших
заместителей относительно двойной взязи,
можно приписать изомеру ту или иную
конфигурацию. На этом основана E,Z -номенклатура  -диастереомеров. -диастереомеров.
Старшинство заместителей определяется точно
так хе, как и при наименовании конфигурации
асимметрического атома по Kaну - Ингольду -Прелогу.
Старшим считается тот атом, который имеет
больший номер в Периодической таблице
Д.И.Менделеева (в случае сложных заместителей при
двойной связи поступают так же, как это описано в
разделе IV.2).
Если старшие заместители находятся по одну
сторону относительно двойной связи, изомеру
приписывают Z-конфигурацию (от немецкого
"zusammen" - вместе)
Если старшие заместители расположены по
разные стороны двойной связи, изомеру
приписывают Е-конфигурацию (от немецкого
"entgegen" - напротив):

Аналогично, цис-бутен-2 получает название: Z
-бутен-2, а транс-бутен-2 будет называться:
Е-бутен-2.
Следует иметь в виду, что когда говорят о Е-
или Z- конфигурации, подразумевают относительную
конфигурацию, поскольку при этом
рассматривается взаимное расположенно
заместителей при двух атомах углерода в
молекулах диастереомеров.
X. Дополнительные сведения.
1.Особенности изображения циклических молекул
Молекулы алициклических соединений неплоские
(за исключением трехчленных циклов) и могут
существовать в различных конформациях. Поэтому,
если важна реальная геометрия цикла, его
изображает с помощью перспективной формулы (то
есть рисунка его шаро-стержневой модели). Атомы
углерода, как правило, не изображают, например:
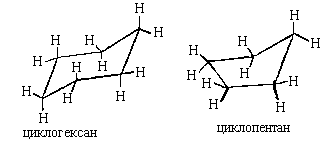
Если же важно передать только взаимное
расположение заместителей в цикле, можно
воспользоваться клиновидной проекцией.При этом
цикл искусственно уплощают и рассматривают его
"сверху", то есть в направлении,
перпендикулярном плоскости цикла. Относительную
конфигурацию изомеров обозначают приставками
цис- или транс- , в зависимости от того, находятся
заместители по одну пли по разные стороны
цикла, например:
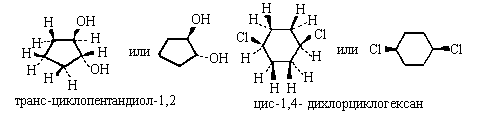
В другом варианте цикл также считают плоским и
располагают его почти перпендикулярно плоскости
чертежа. Ближние к наблюдателю стороны цикла
изобретают утолщенными линиями:
Однако, чаще молекулы алициклов рисуют в виде
правильных многоугольников, подразумевая
при этом, что цикл расположен перпендикулярно
плоскости чертежа. Связи заместителей с атомами
углерода цикла изображают вертикальными
линиями, дополнительно искажая реальную
геометрию молекулы:
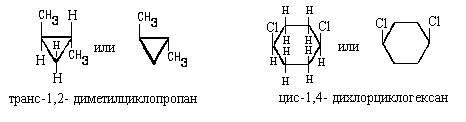
Эти формулы удобны тем, что они подчеркивают
взаимное расположение заместителей в цикле.
В случае конденсированных полициклических
систем используют два варианта изображения. Один
вариант: с помощбю клиновидной проекции
изображают направление связей С-С, отходящих от
общего ребра двух циклов:
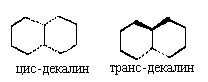
Другой вариант: всю полициклическую систему
уплощают и показывают направление связей С-Н или
С-заместитель в местах сочленения циклов:
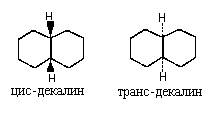
2.Конформационная энантиомерия
Рассмотрим молекулу мезо-формы
2,3-дибромбутана. Изобразим ее заслоненную и
гош-конформации:
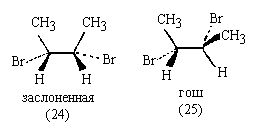
В отличие от заслоненной конформации, в
гош-конформации мезо-формы нет ни одного
элемента симметрии, кроме тривиального
С1.(Иногда при рассмотрении конформации (25)
"находят" зеркально-поворотную ось S6 ,
ошибочно поворачивая одну из групп C(CH3)HBr с
последующим отражением в плоскости. Это неверно!
Зеркально- поворотная ось предполагает поворот всей
молекулы с последующим отражением в
плоскости. В гош-конформации (25) нет оси S6).
Следовательно, молекула в гош-конформации (25)
хиральна. Тем не менее, известно, что мезо-формы
оптически неактивны. На самом деле здесь нет
противоречия. При переходе от заслоненной
конформации (24) к гош-конформации (25) мы
повернули фрагмент С(СН3)НВr в одну
оторону. В реальной молекуле 2,3-дибромбутана
указанный фрагмент млжет с равной вероятностью
повернуться и в противоположную сторону.
При этом образуются две гош-конформации: (25) и (25')
в равном количестве и являющиеся энантиомерами.
Они образуют рацемат, который оптически
неактивен.
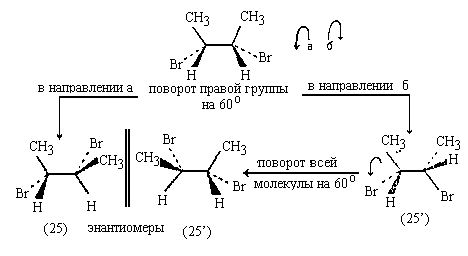
В случае мезо-формы 2,3-дибромбутана
энантиомерные гош-конформации легко переходят
друг в друга за счет врацения вокруг  -связи и вследствие
этого не могут быть выделены в индивидуальном
состоянии. -связи и вследствие
этого не могут быть выделены в индивидуальном
состоянии.
Ecли создать условия, затрудняющие вращение
вокруг  -связи,
то подобные конформационные энантиомеры не
смогут превращаться друг в друга. Такой вариант
возможен, например, при наличии в молекуле
объемистых групп, "мешающих" повороту -связи,
то подобные конформационные энантиомеры не
смогут превращаться друг в друга. Такой вариант
возможен, например, при наличии в молекуле
объемистых групп, "мешающих" повороту  -связи.
Классический пример - замещенные бифенилы.
Изображенные ниже антиподы 6,6'-динитродифеновых
кислот можно выделить в индивидуальной
состоянии. Они не превращаются друг в друга,
поскольку орто-заместители в фенильных
кольцах мешают повороту вокруг -связи.
Классический пример - замещенные бифенилы.
Изображенные ниже антиподы 6,6'-динитродифеновых
кислот можно выделить в индивидуальной
состоянии. Они не превращаются друг в друга,
поскольку орто-заместители в фенильных
кольцах мешают повороту вокруг  -связи. Такие
стереоизомеры называют атропоизомерами (от греч. "atropos"
-неподвижный). -связи. Такие
стереоизомеры называют атропоизомерами (от греч. "atropos"
-неподвижный).
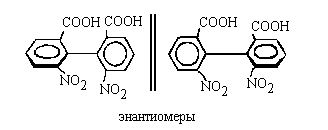
Если объем орто-заместителей в бифениле
постепенно уменьшать, то наступит момент; когда
взаимное превращение энантиомеров станет
возможным вначале при повышенной температуре, а
затем и при комнатной. При небольшом размере
заместителей оптическая активность наблюдаться
не будет, поскольку в этом случае будет
существовать равновесная смесь конформаций,
легко переходящих друг в друга.
Таким образом, в случае больших заместителей в
бифенмле (6,б'-динитродифеновые кислоты) речь идет
о реально выделяемых энантиомерах, а
следовательно, об их конфигурациях. В случае же
малых заместителей мы имеем дело с
конформациями. Отсюда видно, что между понятиями
"конфигурация" и "конформация"
отсутствует четкая граница.
3. Проекции Фишера и для молекул с
тремя и более асимметрическими атомами.
Принцип построения проекций Фишера для молекул
с несколькими асимметрическими атомами тот же,
что и для молекул с двумя такими атомами. При этом
необходимо, чтобы каждый этановый фрагмент
молекулы находился в заслоненной конформации.
Построим проекцию Фишера молекулы D-глюкозы.
Если в D6Вашем распоряжении имеется
шаро-стержневая модель молекулы, то нетрудно
придать этой модели такую форму, в которой все
этановые фрагменты будут в заслоненной
конформации. Для этого надо "заставить"
моделт свернуться так, чтобы Вы могли удержать её
концы (СН=О и СН2ОН) в одной руке. При этом
получится некое подобие позвоночника
нагнувшегося вперед человека: атомы водорода и
гидроксильнне группы, связанные с
acимметрическими атомами, играют роль отростков
позвонков:
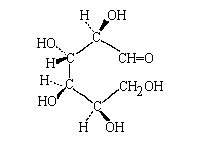
|
"углеродный хребет": заслоненная
конформация молекулы D -глюкозы |
Через связи С-С проведем плоскости,
перпендикулярные плоскости чертежа. При этом
получится поверхность выпуклого многогранника,,
ребра которого походят через атомы углерода.
"Отростки позвонков" -Н и ОН при этом
возвышаются над поверхностью многогранника.
Спроектируем атомы Н и группы ОН на эту
поверхность {точнее, на ее ребра), а затем
развернем наш многогранник, превратив всю его
поверхность в одну плоскость - получим искомую
проекцию Фишера:
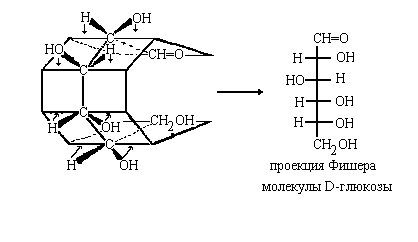
Чаще, однако, приходится переходить к проекции
Фишера от клиновидной проекции зигзагообразной
цепи молекулы, В этой случае можно использвать
следующий алгоритм.
а) Разорвем связи между асимметрическими
атомами (эти связи лежат в плоскости чертежа).
б) Развернем часть полученных фрагментов
относительно вертикальной оси так, чтобы
свободные валентности всех фрагментов
молекулы "смотрели" в одну сторону (вправо
или влево - безразлично).
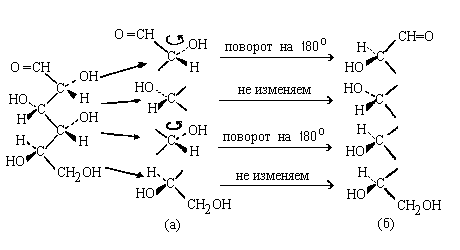
в) Соединим свободные валвентности так, чтобы
все aтомы углерода лежали на одной прямой
(естественно, что при этом мы искажаем углы между
связями).
г) Повернем молекулу вокруг вертикальной оси так,
чтобы всe заместители при асимметрических атомах
возвышались над плоскостью чертежа, и
спроектируем их на эту плоскость.
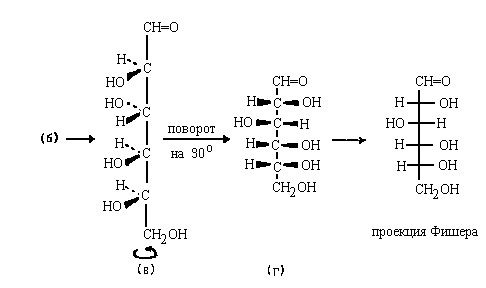
Для того, чтобы от проекции Фишера перейти к
изображению зигзагообразной цепи, все
описанные операции чадо выполнить в обратной
последовательности.
|