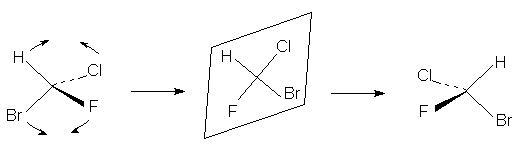|
Бутин К.П. Теоретическая стереохимия/ Органическая химия
8.3. Конфигурация и конформация
Конформация молекулы определяется как
любое относительное расположение атомов
молекулы в пространстве, которое может быть
достигнуто без нарушения целостности молекулы.
Конформационные переходы возникают вследствие
стереохимической нежесткости большинства
молекул, когда происходит свободное вращение
вокруг простых s -связей или деформация валентных
углов. Важно, что одна конформация превращается в
другую без разрыва существующих в молекуле
валентных связей. Как уже говорилось в гл.4 при
обсуждении свободного вращения в алканах, разные
конформации имеют разную энергию. Обычно при
свободном вращении вокруг s -связи энергия
изменяется волнообразно: максимумы чередуются с
минимумами. Минимумы на энергетической кривой
соответствуют изомерным конформерам.
Изучение свободного вращенияи химических
свойств конформеров называется конформационным
анализом. Основы конформационного анализа
циклических углеводородных систем будут даны в
гл.24; конформации алканов уже рассматривались в
гл.4.
Конфигурация молекулы - понятие более
качественное, не так детализирующее положение
атомов в пространстве, как конформация. Конфигурация
- это стереохимическая особенность данного
расположения атомов в пространстве данной
молекулы. Одна и та же стереохимическая
конфигурация может включать в себя множество
конформаций, различающихся друг от друга
величинами соответствующих валентных или
торсионных (двугранных) углов внутреннего
вращения. Конформационные переходы могут
изменить, а могут и не изменить стереохимическую
конфигурацию молекулы.
В качестве примера рассмотрим деформацию
хиральной тетраэдрической молекулы
бромтрихлорметана в плоскую форму
(энергетически очень невыгодную). Такую
деформацию можно осуществить двумя способами.
Во-первых, можно вращать плоскость ClCF
относительно плоскости HCBr. При уменьшении угла j ,
который в исходном тетраэдре равен 900, до j =
0 получаем плоско-квадратный бромтрихлорметан,
который на приведенной выше схеме показан
справа. При вращении в обратную сторону при j = 1800
получаем плоский изомерный тригалометан.
Продолжая поворот плоскости в том же
направлении, при j = 2700 вновь получаем
тетраэдр, но энантиомерный первоначальному.
В облости от 00 < j < 1800 существует
множество искаженных тетраэдров, которым
соответствуют энантиомерные искаженные
тетраэдры в области 1800 < j < 3600.
Внутри каждого из этих двух интервалов изменения
j стереохимическая конфигурация тетраэдра не
меняется. Изменение конфигурации, т.е. переход
левого энантиомера в правый, происходит при j = 00
и j = 1800. где молекула имеет форму другой
фигуры, - плоского квадрата, а не тетраэдра.
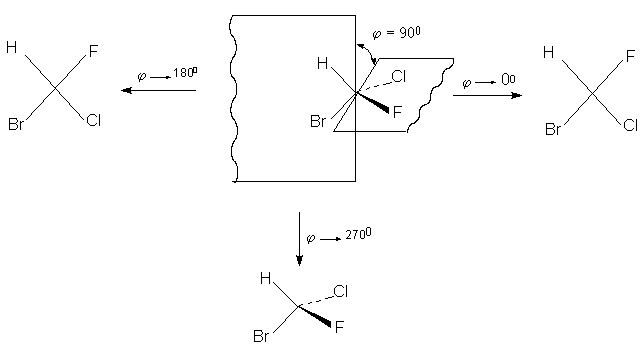
Второй путь перехода хирального тетраэра в
плоский квадрат заключается в изменении
валентных углов от 109,50 до 900, как
показано ниже.
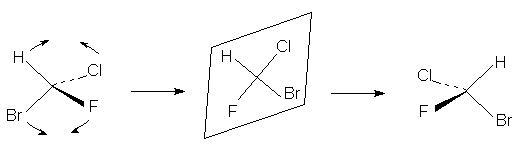
При такой деформации образуется третий изомер
плоско-квадратного бромтрихлорметана, и снова
стереохимическая конфигурация сохраняется
вплоть до достижения планарной формы. Продолжая
указанное движение дальше, придем к
энантиомерной форме исходного тетраэдра.
Хиральный тетраэдр можно перевести в
энантиомер и без промежуточного ахирального
интермедиата, каковым является плоский квадрат
на приведенных выше схемах. Это можно
осуществить следующим образом:
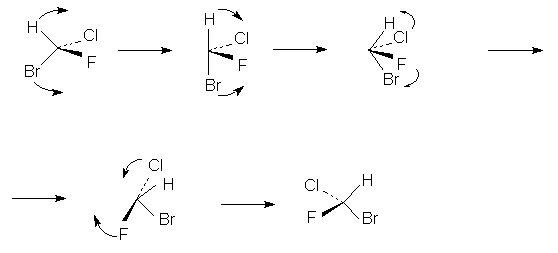
Здесь все фигуры хиральны. Следовательно,
прохождение через ахиральный интермедиат не
обязательное условие изменения
стереохимической конфигурации. Условием
изменения конфигурации является только
изменение молекулярной топологической формы.
Хотя энантиомеризация бромхлорфторметана на
практике не происходит, так как указанные выше
деформации требуют энергии активации большей,
чем энергия разрыва связей в молекуле,
проведенный теоретический анализ доказывает,
что конфигурация характеризует свойства целой
совокупности конформаций и остается неизменной
при конформационных переходах до тех пор, пока не
меняется молекулярная топологическая форма.
Граничные состояния между двумя
стереохимическими конфигурациями могут быть
хиральными или ахиральными, но обязательно
другой топологической формы.
8.3.1. Абсолютная и относительная
конфигурация
Тетраэдрическую модель строения органических
соединений предложили Я.Г.Вант-Гофф и Ж.А.Ле-Бель
в 1874 г. Они пришли к выводу, что если две молекулы
являются стереоизомерами, то их можно описать
зеркальными формулами, и если один изомер
вращает плоскость поляризации влево, то второй
должен вращать вправо. По знаку вращения можно
определить относительную конфигурацию
стереоизомеров. Однако между абсолютной
конфигурацией, т.е. истинным расположением групп
вокруг данного хирального центра, и знаком
вращения прямого соответствия нет. Определить
абсолютную конфигурацию химическими методами,
если не известна абсолютная конфигурация хотя бы
одного хирального реагента (а так и было вначале),
невозможно. Спектральные методы могут дать
информацию только об относительной
конфигурации. В настоящее время существуют лишь
два метода независимого определения абсолютной
конфигурации: теоретический расчет и
исследование аномальной дифракции
рентгеновских лучей на ядрах тяжелых элементов.
Но в конце XIX - начале XX века этих методов не
существовало и поэтому химики придумали
следующий выход. Решили взять в качестве
стандарта какое-нибудь одно соединение и
произвольно приписать ему одну из возможных
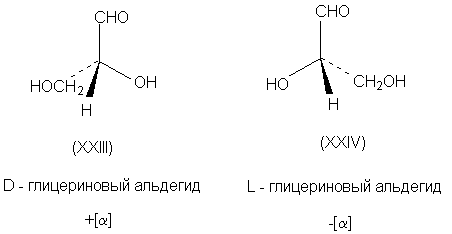
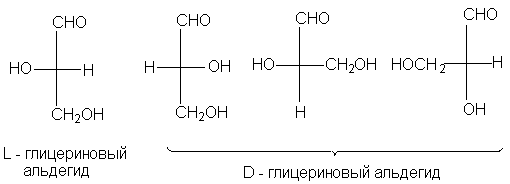
абсолютных конфигураций. Выбор пал на
глицериновый альдегид по той причине, что он
структурно связан с сахарами, которые в то время
изучал Эмиль Фишер. (+) - Изомеру была приписана
абсолютная конфигурация XXIII и он был обозначен
буквой D (dextriogyrus - правый), а соответствующий (-)
- изомер XXIV - буквой L (laevogyrus - левый). Как только
был выбран стандарт, стало возможным соотносить
с ним конфигурацию других соединений. Например,
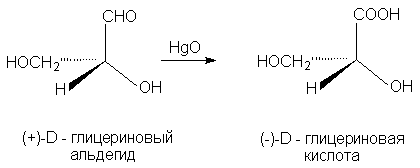
при окислении с помощью HgO (+)-глицериновый
альдегид дает (-)-глицериновую кислоту. Данная
реакция не затрагивает асимметричский атом,
поэтому очень мало вероятно, чтобы его
конфигурация изменилась, и следовательно
(-)-глицериновая кислота относится к D - ряду.
Подобным образом можно провести отнесение
других соединений к той или иной конфигурации
глицеринового альдегида, что было сделано для
многих тысяч соединений. К D - или L - ряду были
отнесены даже такие соединения, которые не имеют
асимметрических атомов, например, аллены и
бифенилы.
8.3.2. Проекции Фишера
Изобразить на бумаге пространственную формулу
сложного органического соединения довольно
трудно. Поэтому в 1891 г. Э. Фишер предложил
представлять пространственное строение в виде
проекций, названных его именем.
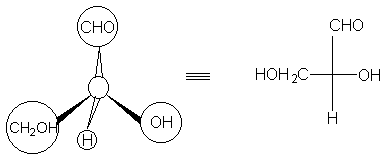
Для построения проекционных формул Фишера
тетраэдр поворачивают так, чтобы две связи,
лежащие в горизонтальной плоскости, были
направлены к наблюдателю, а две связи, лежащие в
вертикальной плоскости, - от наблюдателя. Это
расположение переносят на бумагу:
Поскольку на тетраэдр можно смотреть с разных
сторон, одна модель может дать 12 внешне непохожих
формул Фишера. Чтобы получать правильные
результаты, необходимо помнить, что формулы
Фишера являются проекциями на плоскость, и их
нужно рассматривать иначе, чем пространственные
модели. Поэтому вводится ряд ограничений.
Формулу нельзя выводить из плоскости чертежа и
нельзя поворачивать на 900, хотя поворот на
1800 допустим.
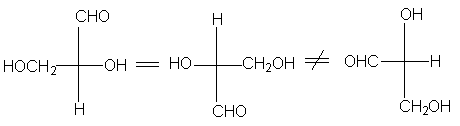
Можно при фиксированном положении одной группы
остальные три вращать по часовой стрелке или
против часовой стрелки. Это равнозначно вращению
вокруг s -связи в пространственных моделях.
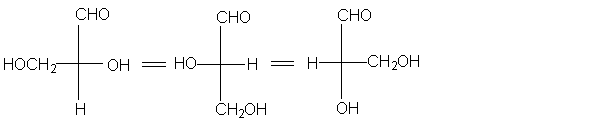
Однако взаимная перестановка любых двух групп в
проекциях Фишера приводит к превращению
энантиомера в его зеркальное отображение.
3D изображения D- и L- изомеров глицеринового альдегида (в формате "Metastream")
Проекции Фишера нельзя применять к молекулам,
хиральность которых связана не с хиральным
центром, а с другими элементами (осью,
плоскостью). В таких случаях необходимо
трехмерное изображение.
|