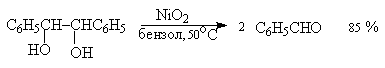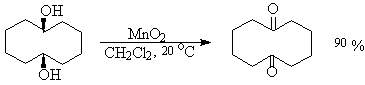
ДВУХАТОМНЫЕ СПИРТЫ
Спирты, содержащие две гидроксильные группы называются диолами. В номенклатуре ИЮПАК в их названии вместо окончания "ол" используют окончание "диол", цифровые локанты обозначают атомы углерода, к которым присоединены эти гидроксильные группы.
1,2-Диолы, содержащие ОН-группы у соседних (вицинальных) атомов углерода, называют также гликолями, Так как их часто получают гидроксилированием алкенов, то это отражается в их названии.
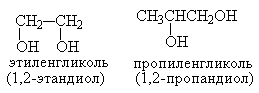
Геминальные диолы, содержащие две гидроксильные группы у одного атома углерода, нестабильны и разлагаются с отщеплением воды и образованием карбонильного соединения.
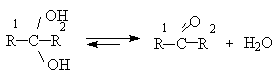
Равновесие в этом процессе смещено вправо, поэтому сами геминальные диолы называют гидратами карбонильных соединений.
I. ПОЛУЧЕНИЕ ДИОЛОВ
Наиболее известным методом получения 1,2-диолов являются реакции стереоселективного син- или анти-гидроксилирования алкенов (см. подробнее в главе "Алкены" в учебной литературе).
Классическим методом получения симметричных 1,2-диолов является восстановительная димеризация кетонов. В качестве восстановителей используют активные двухвалентные металлы - магний, цинк, амальгаму магния в апротонной неполярной среде - бензоле, толуоле, ТГФ. В первой стадии реакции кетон присоединяет один электрон и восстанавливается до анион-радикала, называемого кетилом. Димеризация двух анион-радикалов во второй стадии приводит к алкоголяту 1,2-диола, который затем гидролизуют до диола.
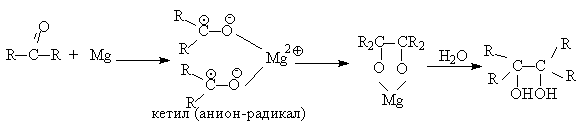 Поскольку диол,
получаемый таким способом из ацетона, имеет
тривиальное название пинакона, эта реакция
получила название пинаконового восстановления.
Поскольку диол,
получаемый таким способом из ацетона, имеет
тривиальное название пинакона, эта реакция
получила название пинаконового восстановления.
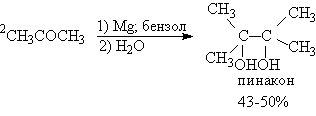
Современные модификации пинаконового восстановления позволяют не только резко повысить выход продуктов восстановительной димеризации кетонов, но и распространить ее на ароматические и алифатические альдегиды. Эти реакции проводят в присутствии TiCL4 (Э.Кори, 1976 г.).
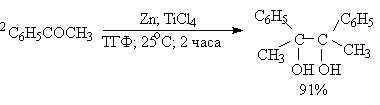
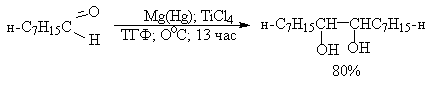
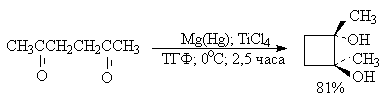
Общим методом получения 1,3-диолов является восстановление соответствующих альдолей в мягких условиях. Выходы продуктов восстановления боргидридом натрия или алюмогидридом лития обычно довольно высокие.
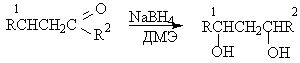
Другой метод синтеза 1,3-диолов основан на реакции гидроксимеркурирования-демеркурирования сопряженных 1,3-диенов. Гидроксимеркурирование сначала осуществляется по более реакционноспособной концевой двойной связи с образованием аллилового спирта. Гидроксильная группа при С-2 аллилового спирта направляет вторую гидроксильную группу в положение 4.
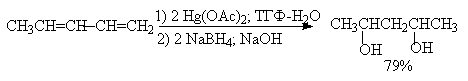
Старинный метод синтеза 1,3-диолов основан на реакции Принса (1917 г.). Формальдегид в присутствии кислого катализатора присоединяется к алкенам с образованием смеси 1,3-диола и циклического ацеталя - производного 1,3-диоксана.
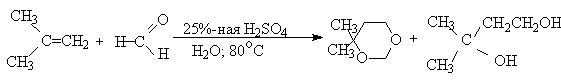
Соотношение 1,3-диола и 1,3-диоксана зависит от структуры алкена. Для алкенов с концевой двойной связью в продуктах преобладает 1,3-диоксан. Симметричные дизамещенные алкены образуют, в основном, 1,3-диол. Выходы диолов в этой реакции невелики и ею чаще пользуются для получения 1,3-диоксанов.
Другие типы диолов обычно получают восстановлением соответствующих дикарбонильных соединений комплексными гидридами металлов.
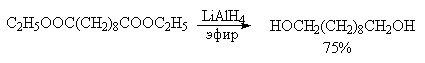
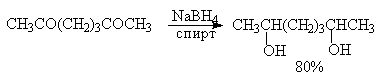
Для диолов характерны те же реакции, что и для одноатомных спиртов. Кроме того, диолы обладают рядом специфических свойств, обусловленных наличием двух гидроксильных групп.
2. СВОЙСТВА ДИОЛОВ
1.Дегидратация
Дегидратация 1,2-диолов может протекать по трем различным направлениям: 1) дегидратация до диенов; 2) дегидратация, сопровождаемая перегруппировкой - так называемая "пинаколиновая перегруппировка"; 3) образование циклических эфиров и эпоксидов. Все эти реакции катализируются кислотными агентами и поэтому в общем случае все направления конкурируют друг с другом. Тем не менее удается подобрать условия, когда одно из направлений становится преобладающим. Дегидратация дитретичных или дивторичных 1,2-диолов до диенов происходит при кипячении с 48%-ной бромистоводородной кислотой или на окиси алюминия при 450-470oС.
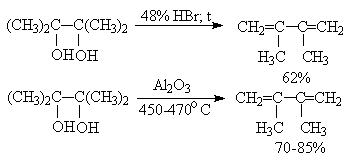
В отличие от этого дегидратация дитретичных, дивторичных и первично-третичных 1,2-диолов, катализируемая серной кислотой, и-толуолсульфокислотой, кислотами Льюиса, сопровождается 1,2-миграцией алкильной или арильной группы или гидрид-иона (пинаколиновая перегруппировка). Продуктами этой перегруппировки являются кетоны или альдегиды.
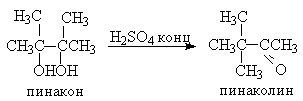
Некоторые наиболее типичные примеры пинаколиновой перегруппировки диолов приведены ниже.
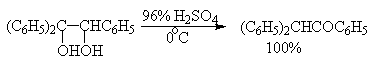
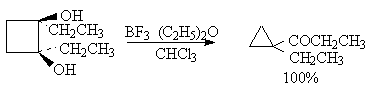
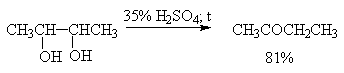
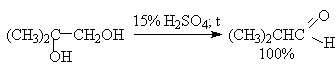
Наибольшее практическое значение для органического синтеза приобрела перегруппировка дитретичных и дивторичных 1,2-диолов, приводящая к кетонам, которая характеризуется высоким выходом карбонильных соединений.
Используя восстановительную димеризацию циклоалканонов и последующую пинаколиновую перегруппировку, можно достаточно простым способом получить спироциклические соединения, содержащие кетогруппу.
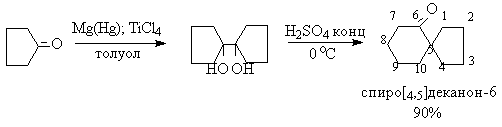
Механизм пинаколиновой перегруппировки очень подробно исследован. В простейшем случае в качестве промежуточной частицы при дегидратации 1,2-диола образуется карбокатион, в котором происходит 1,2-миграция алкильной или арильной групп с образованием протонированной формы карбонильного соединения. Перегруппировка завершается отщеплением протона из оксониевого катиона. Специальными опытами установлено, что конфигурация мигрирующей группы полностью сохраняется в продукте перегруппировки. Это указывает на внутримолекулярный характер 1,2-миграции алкильной группы. Во многих случаях реализуется согласованный процесс без образования карбокатиона в качестве промежуточной частицы. В этом случае отщепление воды происходит из протонированной формы диола с анхимерным содействием мигрирующей группы.
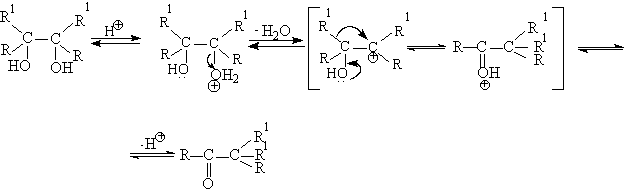
Легко заметить, что такой механизм не требует образования карбокатиона как необходимого условия для 1.2-миграции алкильной или арильной групп.
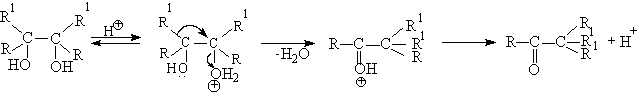
Для тетраарилзамещенных 1,2-диолов был установлен механизм перегруппировки, в котором в качестве промежуточного продукта образуется эпоксид.
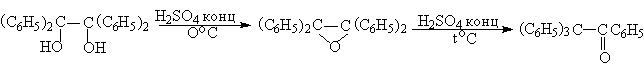
Таким образом, в зависимости от структурных факторов механизм пинаколиновой перегруппировки 1,2-диолов может быть различным. Определен ряд мигрирующей способности групп:
![]()
Этиленгликоль и другие 1,2-диолы общей формулы RCH(OH)CH2OH при нагревании с концентрированной серной, 85%-ной фосфорной кислотами или п-толуолсульфокислотой дают 1,4-диоксаны - циклические простые эфиры с двумя атомами кислорода. Циклодегидратация 1,4-диолов и 1,5-диолов в тех же условиях служит наиболее важным способом получения производных тетрагидрофурана и тетрагидропирана, соответственно.
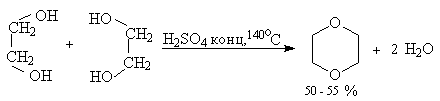
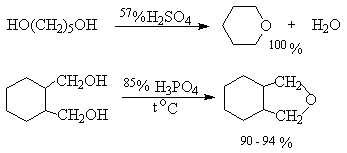
Этот метод не пригоден для получения оксиранов из 1,2-диолов, оксетанов из 1,3-диолов и циклических простых эфиров с числом звеньев цикла более шести из a,v -диолов.
2. Окислительное расщепление 1,2-диолов
Существуют два классических метода окислительного метода расщепления 1,2-диолов и полиолов с помощью параиодной кислоты H5IO6 и ее солей (Л.Малапрад, 1928 г.) и с помощью тетраацетата свинца Pb(OOCCH3)4 (Р.Криге, 1931 г.). тетраацетат свинца получают при взаимодействии сурика Pb3O4 и уксусного ангидрида в уксусной кислоте.
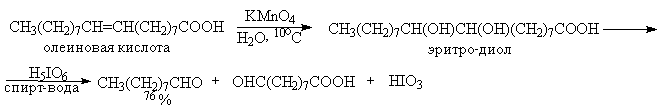
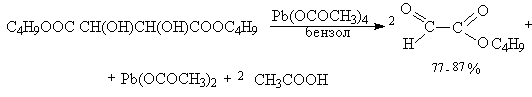
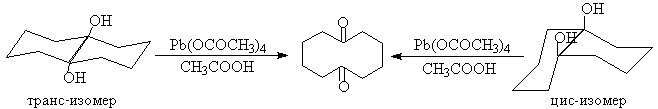
Образование циклических сложных эфиров объясняет более быстрое окисление цис-изомеров циклических диолов по сравнению с транс-изомерами.
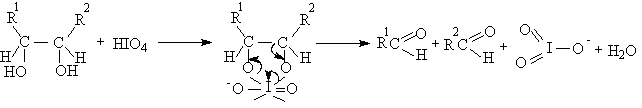
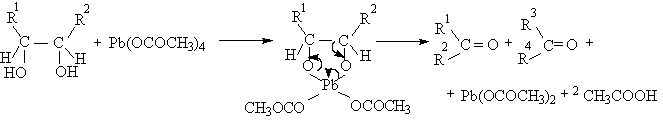
Пространственные факторы, которые затрудняют образование циклического интермедиата, уменьшают и скорость окислительной деструкции. Однако тетраацетат свинца окисляет также и 1,2-диолы, не способные к образованию циклического эфира из-за большого расстояния между гидроксильными группами. Так например, транс-9,10-дигидроксидекалин окисляется тетрарацетатом свинца до циклодекадиона-1,6, хотя окисление транс-изомера протекает в 300 раз медленнее, чем цис-изомера, который может давать циклический интермедиат.
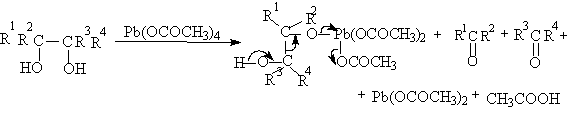
Другие реагенты для окислительного расщепления 1,2-диолов по селективности и доступности уступают иодной кислоте и тетраацетату свинца. Это относится к солям церия (IV), ванадия(V), фенилиодозоацетату C6H5I(OCOCH3)2. В некоторых случаях для окисления диолов в нейтральной среде применяют пероксид никеля NiO2 и оксид марганца (IV):