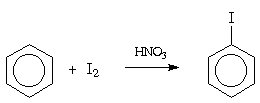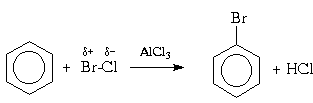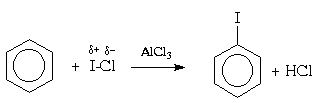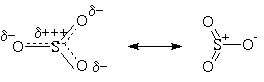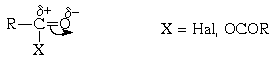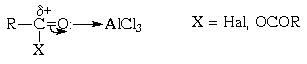|
Зык Н.В., Белоглазкина Е.К."Ароматичность и ароматические углеводороды"/ Органическая химия
Д. Реакции с конкретными
электрофилами
Нитрование
Реакция нитрования является одной из наиболее
изученных реакций ароматического замещения. Для
препаративных целей нитрование, как правило,
проводят смесью концентрированных азотной и
серной кислот, так называемой нитрующей
смесью . На первой стадии реакции
происходит образование иона нитрония +NO2,
который и является электрофильным агентом:
HO-NO2 + H2SO4 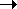 H2O+-NO2 + HSO4- H2O+-NO2 + HSO4-
H2O+-NO2 + H2SO4 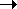 H3O+ + HSO4-
+ +NO2 H3O+ + HSO4-
+ +NO2
Наличие иона нитрония в этом растворе
подтверждено спектроскопически. Азотная кислота
в концентрированной серной кислоте практически
нацело превращается в нитроний-катион.
Незначительная эффективность самой азотной
кислоты в реакции нитрования бензола
объясняется низким содержанием иона +NO2.
B качестве нитрующих агентов используются
также другие системы, в которых генерируется
либо катион +NO2, либо соединение общей
формулы NO2-Y где Y - хорошая уходящая группа.
Некоторые из таких систем, нашедшие наибольшее
применение, представлены в таблице 1 в порядке
увеличения их активности.
Таблица 1. Нитрующие реагенты.
| Нитрующий реагент |
Метод генерации |
Арены, подвергающиеся нитрованию |
Азотная кислота
HO-NO2 |
|
Фенолы, эфиры фенолов, бифенил |
| Ацетилнитрат CH3C(O)-O-NO2 |
СН3СООН + HNO3 (СН3СО)2О
+ HNO3 |
Бензол, алкилбензолы |
Диоксид азота
N2O4 (O=N-O-NO2) |
|
Бензол, алкилбензолы |
| Нитрующая смесь |
H2SO4 конц + HNO3 |
Бензол, алкилбензолы,
галогенбензолы, бензойная кислота, нитробензол,
нафталин |
Хлорид нитрония
Сl-NO2 |
|
Бензол, алкилбензолы,
нитробензол, |
| Тетрафторборат нитрония BF4-+NO2 |
HF.2BF3 + HNO3 |
Динитробензол |
На примере реакции нитрования алкилбензолов
отчетливо прослеживается влияние
пространственных факторов на направление
электрофильного замещения. Так, при нитровании
толуола (метилбензола) орто-изомер
образуется в качестве основного продукта, а при
переходе к этил-, изо-пропил- и особенно к трет-бутил-бензолу
его выход существенно уменьшается (см. табл. 2).
Таблица 2. Влияние пространственых
факторов на соотношение орто-, пара-изомеров в
реакции нитрования (NO2+)
С6H5-R |
Замещение в
положения, % |
| |
орто- |
мета- |
пара- |
C6H5-CH3 |
57 |
40 |
3 |
C6H5-C2H5 |
45 |
48 |
7 |
C6H5-CH(CH3)2 |
30 |
62 |
8 |
C6H5-C(CH3)3 |
12 |
79 |
9 |
При изучении нитрования алкилбензолов было
обнаружено так называемое ипсо-замещение
, когда электрофильная атака протекает по тому
атому углерода бензольного кольца, которое уже
содержит заместитель, например:
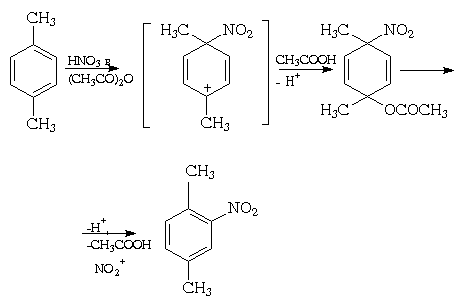
Ипсо-атака обычно имеет место при
несогласованной ориентации заместителей
первого рода (особенно, находящихся в пара-положении).
Она имеет место для практически всех
алкилбензолов, а также галоген- и
алкоксиалкилбензолов с подобным расположением
заместителей.
Галогенирование
В отличие от нитрования, при галогенировании
атака ароматического субстрата может
осуществляться различными электрофилами.
Свободные галогены, например, Cl2 и Br2,(прим.35) могут легко атаковать
активированное ароматическое ядро (например,
фенола), но не способны реагировать с бензолами и
алкилбензолами (фотохимическая активация может,
однако, в последнем случае привести к протеканию
радикального замещения в боковую цепь; см. раздел
IV.3). Для поляризации атакующей молекулы галогена
необходим катализ кислотами Льюиса,
такими как AlCl3, FeBr3, и т.п.; при этом в
молекуле галогена появляется так называемый
"электрофильный конец" (энергия же,
требующаяся для образования катиона Наl+
существенно выше). Тем самым электрофильное
замещение существенно облегчается:
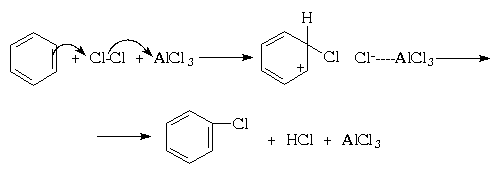
Галогенирование протекает очень энергично,
если использовать реагенты, в которых галоген в
результате поляризации имеет сильный
положительный заряд или даже существует как
катион. Так, очень инертный мета-динитробензол
можно пробромировать бромом в концентрированной
серной кислоте в присутствии сульфата серебра.
Предполагают, что в этом случае промежуточно
образуется бром-катион:
2Br2 + Ag2SO4  2Br+ + 2AgBr + SO42- 2Br+ + 2AgBr + SO42-
Реакционная способность элементарного иода
в реакциях электрофильного замещения в
ароматическом ядре незначительна, так что прямое
иодирование возможно только в случае фенола и
ароматических аминов. Иодирование других
ароматических соединений проводят в присутствии
окислителя (обычно, азотной кислоты). Считается,
что в этих условиях роль электрофильного агента
играет ион I-+OH2.
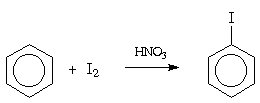
Для галогенирования аренов можно применять
также смешанные галогены, например,
монохлорид брома (BrCl) или иода (ICl):
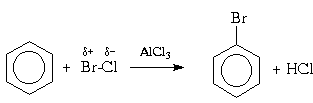
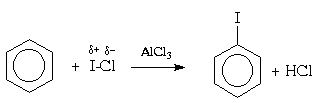
Галогенирование in vivo. В качестве
примера электрофильного ароматического
галогенирования, протекающего в живых
организмах, можно привести реакцию иодирования  -аминокислоты - тирозина в
ходе биосинтеза иодсодержащих гормонов
щитовидной железы до 3-иодтирозина и далее до
3,5-дииодтирозина: -аминокислоты - тирозина в
ходе биосинтеза иодсодержащих гормонов
щитовидной железы до 3-иодтирозина и далее до
3,5-дииодтирозина:
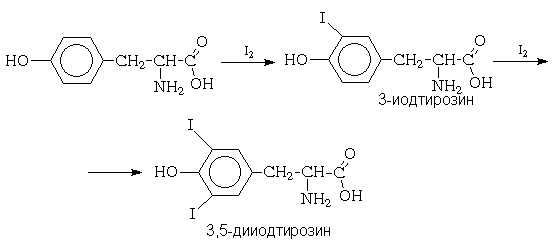
Сульфирование
Детали механизма сульфирования исследованы
менее подробно по сравнению с нитрованием и
галогенированием. Сам бензол сульфируется
довольно медленно горячей концентрированной
серной кислотой, но быстро - олеумом, SO3 в
инертных растворителях или комплексом SO3 с
пиридином. Природа электрофильной частицы
зависит от условий реакции, но, вероятно, это
всегда SO3, или в свободном состоянии, или
связанный с "носителем", например, в виде H2SO4.SO3
(H2S2O7) в серной кислоте.
Небольшие количества SO3 образуются в H2SO4:
2H2SO4 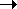 SO3 + H3O+ + HSO4-
SO3 + H3O+ + HSO4-
Атаку ароматического субстрата осуществляет
атом серы поскольку он сильно положительно
поляризован, то есть электронодефицитен:
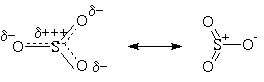
Сульфирование является обратимым
процессом. Это имеет практическое значение: при
обработке сульфокислот водяным паром происходит
замещение группы SO3Н на водород. Таким
образом, можно ввести группу SO3Н как
заместитель, ориентирующий требуемым образом
последующие реакции (см. раздел IV.1.Б), а затем ее
отщепить. Некоторые интересные особенности
имеет сульфирование нафталина (см. раздел IV.1.Г).
Алкилирование по Фриделю-Крафтсу
Подобно галогенам, алкилгалогениды могут быть
так сильно поляризованы кислотами Льюиса
(хлоридами алюминия и цинка, трифторидом бора и
др.), что они становятся способными к
электрофильному замещению в ароматическом ядре:
R-Cl + AlCl3  R R +...Cl... +...Cl... -AlCl3 -AlCl3  R+AlCl4-
R+AlCl4-
R+AlCl4- + ArH  Ar-R + HCl + AlCl3(прим.36) Ar-R + HCl + AlCl3(прим.36)
Кроме алкилгалогенидов, источниками
карбокатионов для галогенирования
ароматических соединений могут быть алкены или
спирты. При этом необходимо присутствие
протонной кислоты, чтобы протонировать алкен или
спирт. В случае спиртов требуется добавка не
менее чем эквимольного количества кислоты (так
как вода, выделяющаяся в ходе реакции,
дезактивирует эквимольное количество
катализатора), тогда как в реакциях с участием
алкилгалогенидов и алкенов достаточно добавлять
незначительное количество катализатора.
В лаборатории алкилирование по Фриделю-Крафтсу
имеет ограниченное применение, так как обычно
при этой реакции образуются смеси продуктов, что
обусловлено рядом причин:
1) Образующийся продукт алкилирования легче
вступает в реакции электрофильного
ароматического замещения, чем исходное
соединение (Alk - электронодонорная группа),
поэтому дальше преимущественно алкилируется
продукт. Если хотят получить продукты
моноалкилирования, то необходимо брать большой
избыток ароматического соединения.
2) Как и сульфирование, реакция алкилирования по
Фриделю-Крафтсу обратима (см. также раздел
IV.1.Г).
3) Даже в мягких условиях первичные и вторичные
алкилгалогениды дают преимущественно вторичные
или третичные алкиларены соответственно,
поскольку алкилирование происходит в условиях,
приближающихся к SN1 реакции.(прим.37)
Перегруппировки можно избежать, если работать
при низких температурах.
Ацилирование по Фриделю-Крафтсу
Ацилирование ароматических соединений по
Фриделю-Крафтсу является важнейшим методом
синтеза жирноароматических кетонов. Производные
карбоновых кислот, такие как ацилгалогениды и
ангидриды, имеют полярную карбонильную группу и
в принципе способны к электрофильному замещению
в ароматических системах:
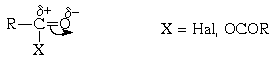
Электрофильная активность этих соединений,
однако, невелика, и должна быть повышена
действием кислот Льюиса. При этом кислотный
катализатор, как правило, атакует атом
кислорода карбонильного соединения и, смещая
электронную плотность, повышает положительный
заряд соседнего атома углерода. В результате
образуется поляризованный комплекс (а в пределе -
ацилкатион), действующий как электрофил:
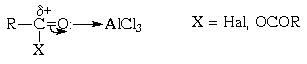
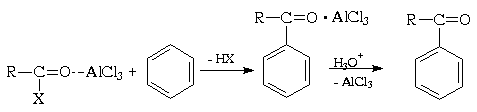
Важное отличие реакции ацилирования
ацилгалогенидами от реакции алкилирования
алкилгалогенидами состоит в том, что в первой из
этих реакций требуется более 1 моль кислоты
Льюиса, тогда как во второй необходимо только
каталитические количество. Это обусловлено тем,
что кислота Льюиса образует комплекс как с
ацилирующим производным карбоновой кислоты, так
и с кетоном - продуктом реакции. При
взаимодействии с ангидридами получающаяся
кислота связывает еще моль моль катализатора,
так что в целом его необходимо по крайней мере
два моль. В каждом случае по окончании реакции
образовавшийся комплекс кетона с хлоридом
алюминия (или другой кислотой Льюиса) должен быть
гидролитически разрушен (соляной кислотой со
льдом).
Полиацилирования не наблюдается, поскольку
образующийся кетон значительно менее
реакционноспособен, чем исходное соединение (см.
раздел IV.1.Б). Поэтому алкилбензолы часто
предпочитают получать не прямым алкилированием,
а ацилированием по Фриделю-Крафтсу с последующим
восстановлением. Ароматические соединения с
сильнодезактивирующими заместителями, например,
нитро- или циано- группами, также не ацилируются
по Фриделю-Крафтсу.
Контрольные задачи
2. Изобразите диаграмму потенциальной энергии
для реакции электрофильного ароматического
замещения, в которой медленной стадией является
образование
 -комплекса (например,
нитрование бензола борфторидом нитрония; -комплекса (например,
нитрование бензола борфторидом нитрония;
см. раздел IV.1.A).
3. Какой продукт преимущственно образуется при
бромировании: а)пара-нитротолуола; б) мета-нитробензолсульфокислоты;
в) орто-нитрофенола.
4. Адреналин
(1-(3',4'-дигидроксифенил)-2-метиламиноэтанол)-
первый гормон, выделенный из мозгового вещества
надпочечников, в настоящее время синтезируюют в
три стадии из пирокатехина. Напишите уравнение
первой стадии этого синтеза - реакции
ацилирования пирокатехина (1,2-дигидроксибензола)
хлорангидридом хлоруксусной киcлоты и объясните
механизм).
5. Одной их качественных реакций на белки
является ксантопротеиновая реакция, указывающая
на присутствие ароматических  -аминокислот. Она заключается в обработке
белка азотной кислотой при нагревании. Напишите
уравнение ксантопротеиновой реакции с тирозином
(см. раздел I), образовавшимся в результате
гидролиза белка. -аминокислот. Она заключается в обработке
белка азотной кислотой при нагревании. Напишите
уравнение ксантопротеиновой реакции с тирозином
(см. раздел I), образовавшимся в результате
гидролиза белка.
|