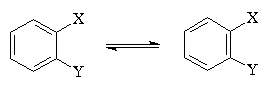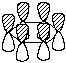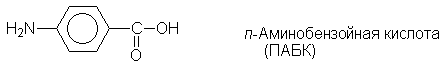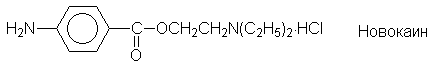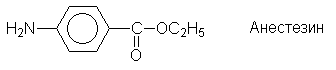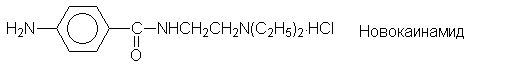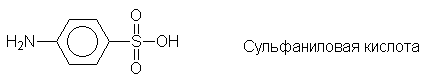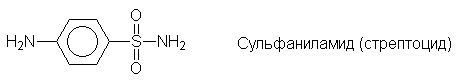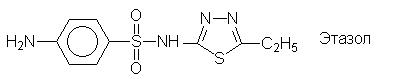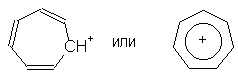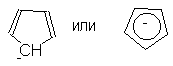|
Зык Н.В., Белоглазкина Е.К."Ароматичность и ароматические углеводороды"/ Органическая химия
I. Введение.
Первый ароматический углеводород - бензол - был
выделен М.Фарадеем в 1825 году; Фарадей установил
его брутто-формулу - СnHn. Термин
"ароматический" возник потому, что многие
соединения - бензальдегид, бензиловый спирт,
эфиры бензойной кислоты были выделены из
различного рода ладанов, ароматических масел и
бальзамов. Даже после установления
четырехвалентности углерода и введения понятия
о кратных связях в алкенах и алкинах, строение
бензола и других ароматических углеводородов
(аренов) оставалось загадкой, поскольку, являясь
формально ненасыщенным соединением, они были
удивительно инертны в реакциях присоединения.
В 1865 году А.Кекуле предложил для бензола
структурную формулу циклогексатриена-1,3,5:
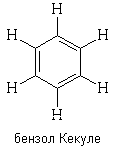
В этой формуле все атомы углерода эквивалентны.
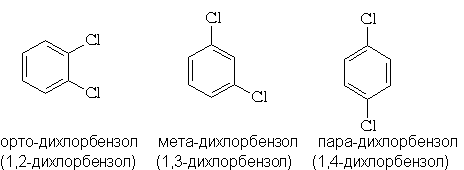
Формула Кекуле объясняет также существование
трех дизамещенных производных бензола: орто-
(1,2-), мета- (1,3)- и пара (1,4)-:
Несимметричные 1,2-дизамещенные производные
бензола, согласно формуле Кекуле, должны были
существовать в виде двух различных форм:

Реально существует лишь один орто-изомер.
Для того, чтобы устранить это несоответствие,
Кекуле предположил, что двойные связи в
1,3,5-циклогексатриене непрерывно перемещаются, и
оба изомера быстро превращаются друг в друга
(теория "осцилляции валентности"):
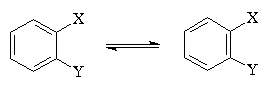
Хотя формула Кекуле никак не объясняет
отсутствие свойств ненасыщенных соединений у
ароматических углеводородов (прим.1)
, она используется и в настоящее время.
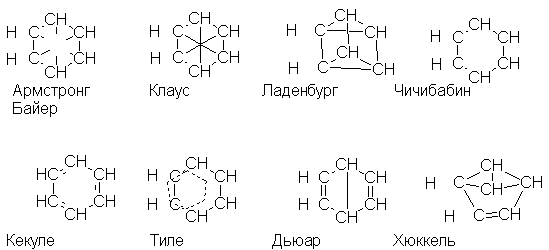
Пытаясь объяснить свойства бензола
особенностями строения, многие ученые
предлагали другие структурные формулы. Так,
Армстронг и Байер, а также Клаус предполагали,
что в молекуле бензола четвертые валентности
всех шести атомов углерода направлены к центру и
насыщают друг друга; Ланденбург - что углеродный
скелет бензола представляет собой призму;
Чичибабин - что в бензоле углерод трехвалентен;
Тиле - что двойные связи в бензоле не фиксированы,
а постоянно перемещаются - "осциллируют";
Дьюар и Хюккель предлагали формулы с малыми
циклами и двойными связями:
Данные современных физико-химических
исследований однозначно указывают на
эквивалентность всех углерод-углеродных связей
в бензоле. Согласно этим данным, бензол
представляет собой правильный шестиугольник с
длиной углерод-углеродной связи 1.40 А (прим.2)
и валентным углом 120о. Образование  -связей углерод-углерод
можно представить как результат перекрывания sp2-гибридных
орбиталей углерода, при этом шесть
негибридизованных р-орбиталей шести атомов
углерода образуют замкнутую -связей углерод-углерод
можно представить как результат перекрывания sp2-гибридных
орбиталей углерода, при этом шесть
негибридизованных р-орбиталей шести атомов
углерода образуют замкнутую  -систему за счет бокового попарного
перекрывания. Образующийся при этом секстет -систему за счет бокового попарного
перекрывания. Образующийся при этом секстет  -электронов обусловливает
особые свойства и стабильность бензола. -электронов обусловливает
особые свойства и стабильность бензола.
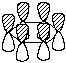
Структурную формулу бензола было бы логичнее
изображть в виде правильного шестиугольника, в
котором сплошное кольцо символизирует секстет  -электронов: -электронов:
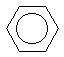
Эта формула часто употребляется в химической
литературе. Однако, с целью сохранения обычных
представлений о четырехвалентности углерода,
химики до сих пор пользуются и формулой Кекуле,
отчетливо сознавая ее достоинства и недостатки.
Циклические ароматические фрагменты входят в
число многих важных биологически активных
соединений. Ниже приведена формула одной из
природных  -аминокислот -
тирозина - являющейся ароматическим соединением: -аминокислот -
тирозина - являющейся ароматическим соединением:
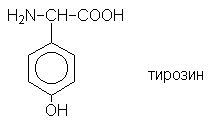
Функционально замещенные ароматические
углеводороды давно и широко используются в
медицине. Так, сложные эфиры пара-аминобензойной
кислоты (ПАБК) являются местноанестезирующими
средствами (анестезин, новокаин и т.п.):
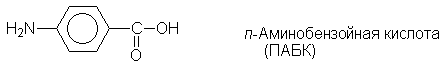
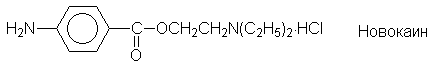
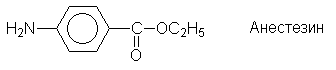
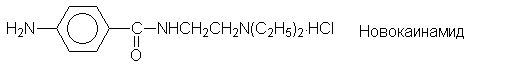
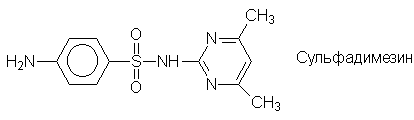
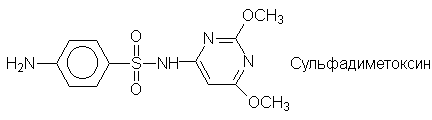
Еще одним большим классом лекарственных
препаратов являются сульфаниламидные средства -
производные сульфаниловой кислоты:
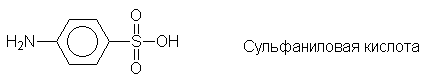
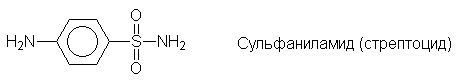
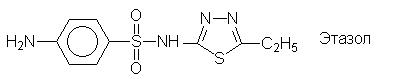
II. Понятие ароматичности
Оценка энергии молекулы бензола путем
определения теплоты гидрирования (прим.3)
показывает, что последняя составляет 206 кДж/моль,
что существенно меньше, чем утроенное значение
теплоты гидрирования изолированной двойной
связи циклогексена (119 кДж/моль х 3 = 357 кДж/моль).
Отсюда следует, что молекула бензола обладает
меньшей энергией, чем ее следовало бы ожидать для
циклогексатриена. Разность указанных значений
составляет (357-206) = ~ 150 кДж/моль и называется энергией стабилизации, энергией
делокализации или энергией резонанса.
Очевидно, делокализация  -электронов
в бензольном кольце, приводящая к неразличимости -электронов
в бензольном кольце, приводящая к неразличимости
 -связей, дает выигрыш
энергии по сравнению с состоянием, когда эти
связи локализованы. Реакции, приводящие к
нарушению системы -связей, дает выигрыш
энергии по сравнению с состоянием, когда эти
связи локализованы. Реакции, приводящие к
нарушению системы  -связей,
приводят к потере этого выигрыша и поэтому
затруднены. Этим и объясняется устойчивость
бензола к действию большинства восстановителей,
окислителей и электрофильных реагентов. -связей,
приводят к потере этого выигрыша и поэтому
затруднены. Этим и объясняется устойчивость
бензола к действию большинства восстановителей,
окислителей и электрофильных реагентов.
Таким образом, ароматичность можно
определить как особую стабилизацию
делокализованной циклической  -cистемы. -cистемы.
II.1.Концепция ароматичности Хюккеля
Устойчивость соединения к действию
окислителей или других электрофильных реагентов
зависит от реакционной способности последних и
особенностей строения субстрата. В связи с этом
долгое время понятие ароматичности
формулировалось не всегда однозначно. В 1931 году
на основании представлений квантовой механики
Э.Хюккель дал определение, позволяющее
производить отнесение той или иной системы к
ароматическим.
Правило Хюккеля: ароматической является
плоская моноциклическая сопряженная система,
содержащая (4n + 2)  -электронов
(где n = 0,1,2...).(прим.4) Так, для
бензола число -электронов
(где n = 0,1,2...).(прим.4) Так, для
бензола число  -электронов
равно 6; таким образом он удовлетворяет
Хюккелевскому критерию атоматичности (n = 1).
Число (4n + 2) называется Хюккелевским
числом электронов (прим.5) . -электронов
равно 6; таким образом он удовлетворяет
Хюккелевскому критерию атоматичности (n = 1).
Число (4n + 2) называется Хюккелевским
числом электронов (прим.5) .
Следует отметить, что в образовании
сопряженной системы электронов могут
участвовать не только  -электроны,
но и неподеленная электронная пара или пустая
р-орбиталь, следовательно, ароматическими
могут быть не только нейтральные, но и заряженные
частицы - катионы и анионы. Так, были получены
устойчивые катион тропилия и анион
циклопентадиенилия: -электроны,
но и неподеленная электронная пара или пустая
р-орбиталь, следовательно, ароматическими
могут быть не только нейтральные, но и заряженные
частицы - катионы и анионы. Так, были получены
устойчивые катион тропилия и анион
циклопентадиенилия:
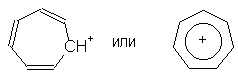
|
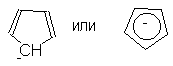
|
Нетрудно видеть, что число  -электронов
в обеих этих системах равно шести, как и в случае
бензола (4n+2; n = 1). -электронов
в обеих этих системах равно шести, как и в случае
бензола (4n+2; n = 1).
Чтобы лучше понять причины большей
устойчивости бензола по сравнению с другими
непредельными системами, рассмотрим его с
позиции теории молекулярных орбиталей.(прим.6) При этом будем учитывать
только валентные р-электроны, находящиеся на
молекулярных  -орбиталях. -орбиталях.
В теории молекулярных орбиталей
предполагается, что электроны в молекуле
принадлежат не отдельным атомам, и не отдельной
химической связи, а всей молекуле. Уровни
энергии, на которых располагаются электроны,
называются молекулярными орбиталями
(МО). Каждая молекула имеет определенное
количество МО (определяемое числом и природой
атомов, входящих в состав молекулы), которые
могут быть свободными или занятыми.
Заполнение орбиталей электронами происходит,
начиная с наиболее низкой по энергии МО; на
каждой орбитали может находиться не более двух
электронов; два электрона, находящиеся на одной
орбитали, имеют антипараллельные
(противоположно направленные) спины.
Молекулярные орбитали делятся на связывающие,
несвязывающие и антисвязывающие (разрыхляющие).
Если заполнение орбитали энергетически выгодно
(то есть энергия молекулы понижается при
помещении электрона на данную орбиталь), то такая
МО называется связывающей; если, наоборот
- заполнение орбитали энергетически невыгодно
(то есть энергия молекулы повышается при
помещении электрона на данную орбиталь), то это антисвязывающая
МО; если же при заполнении орбитали нет ни
выигрыша, ни проигрыша в энергии, говорят о несвязывающей
МО. Таким образом, оценив характер заполненных
МО, можно судить об устойчивости молекулы.
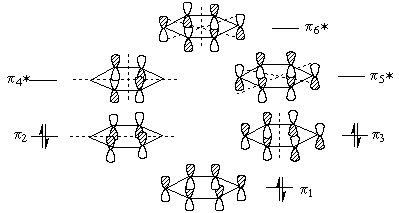
Cогласно теории МО, шесть атомных р-орбиталей
атомов углерода комбинируются с образованием
шести молекулярных  -орбиталей,
из которых три связывающие, а три - разрыхдя.щие.
На рисунке ниже показаны симметрия и узловые
свойства молекулярных -орбиталей,
из которых три связывающие, а три - разрыхдя.щие.
На рисунке ниже показаны симметрия и узловые
свойства молекулярных  -орбиталей
бензола. Связывающая МО -орбиталей
бензола. Связывающая МО  1
c самой низкой энергией не имеет узлов и
охватывает все шесть атомов углерода. За ней
следуют две вырожденные по энергии связыывающие
МО 1
c самой низкой энергией не имеет узлов и
охватывает все шесть атомов углерода. За ней
следуют две вырожденные по энергии связыывающие
МО  2 и 2 и  3, каждая из которых имеет по одному
узлу. Узел на орбитали 3, каждая из которых имеет по одному
узлу. Узел на орбитали  2
перпендикулярен узлу на орбитали 2
перпендикулярен узлу на орбитали  3. Так как в бензоле имеется шесть 3. Так как в бензоле имеется шесть  -электронов, каждая из
связывающих МО -электронов, каждая из
связывающих МО  1, 1,  2 и 2 и  3 занята парой электронов с
противоположными спинами. Остальные три МО
бензола -
3 занята парой электронов с
противоположными спинами. Остальные три МО
бензола -  4*, 4*,  5* и 5* и  6* - разрыхляющие орбитали,
вакантные в основном состоянии. Орбитали 6* - разрыхляющие орбитали,
вакантные в основном состоянии. Орбитали  4* и 4* и  5* вырождены и имеют по два
узла; орбиталь 5* вырождены и имеют по два
узла; орбиталь  6*
имеет три узла. 6*
имеет три узла.
Для оценки устойчивости циклических полностью
сопряженных полиенов удобно пользоваться
простым мнемоническим приемом, известным под
названием круг Фроста. Для этого
правильный многоугольник, с числом углов, равным
количесву атомов углерода в цикле, вписывают в
круг таким образом, чтобы одна из вершин
находилась в самой низшей точке круга. Точки, в
которых вершины многоугольника касаются круга,
считают уровнями энергии молекулярных  -орбиталей. При этом оценка уровней
энергии -орбиталей. При этом оценка уровней
энергии  -орбиталей сводится
к решению простой чисто геометрической задачи. -орбиталей сводится
к решению простой чисто геометрической задачи.
Горизонтальный диаметр обозначает
несвязывающий уровень; орбитали, расположенные
ниже горизонтального диаметра - связывающие, а
расположенные выше - антисвязывающие.(прим.7)
Используем этот подход для оценки прочности
бензола и циклобутадиена - систем плоских и
сопряженных. На рисунке ниже приведены
соответствующие диаграммы уровней энергий их  -орбиталей. -орбиталей.
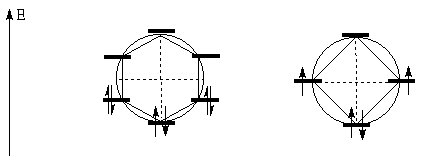
Как видно из рисунка, в случае бензола все шесть
 -электронов располагаются
попарно на трех связывающих орбиталях. Три
антисвязывающие орбитали бензола в основном
электронном состоянии не заняты электронами.
Такая система устойчива.(прим.8) В
случае же циклобутадиена из четырех -электронов располагаются
попарно на трех связывающих орбиталях. Три
антисвязывающие орбитали бензола в основном
электронном состоянии не заняты электронами.
Такая система устойчива.(прим.8) В
случае же циклобутадиена из четырех  -электронов на связывающей орбитали
могут быть расположены только два электрона, два
же других должны оказаться на несвязывающей
орбитали, точнее (по правилу Гунда) - по одному на
обеих несвязывающих. Таким образом,
циклобутадиен должен представлять собой
бирадикал, то есть быть весьма неустойчивым, что
и наблюдается на практике (см. раздел II.2).(прим.9) -электронов на связывающей орбитали
могут быть расположены только два электрона, два
же других должны оказаться на несвязывающей
орбитали, точнее (по правилу Гунда) - по одному на
обеих несвязывающих. Таким образом,
циклобутадиен должен представлять собой
бирадикал, то есть быть весьма неустойчивым, что
и наблюдается на практике (см. раздел II.2).(прим.9)
Аналогично, графическим методом может быть
проведена оценка устойчивости других
нейтральных и заряженных циклических
сопряженных полиенов.
Контрольные задачи
1. Оцените (при помощи круга Фроста)
устойчивость следующих циклических сопряженных
полиенов: а) циклооктатетраен; б)
циклопропенилий-катион; в)
циклопропенилий-анион.
|