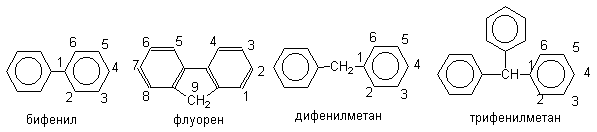
2.7. Электрофильное замещение в полиядерных бензоидных ароматических системах
Полиядерные ароматические соединения можно разделить на два основных типа:
1. Соединения, в которых бензольные ядра изолированы и в определенной степени автономны.
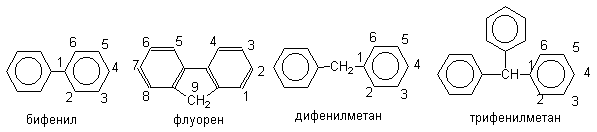
2. Соединения с конденсированными бензольными ядрами.
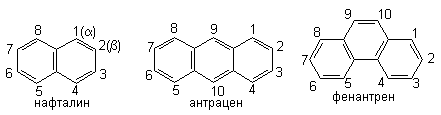
2.7.1.Электрофильное замещение в полиядерных ароматических системах с изолированными бензольными ядрами
Наиболее важным и интересным представителем этого типа ароматических соединений является бифенил. Напомним, что в основном состоянии молекула бифенила обладает практически свободным вращением вокруг центральной С-С-связи, бензольные кольца в растворах наклонены друг к другу под углом 45оС вследствие взаимного отталкивания орто-атомов водорода; энергия стабилизации бифенила приблизительно равна удвоенной энергии стабилизации бензола, т.е. бензольные кольца в бифениле достаточно автономны.
Экспериментальные данные показывают, что бифенил в реакциях электрофильного замещения более активен, чем бензол. Электрофильные реагенты атакуют орто- и пара-положения фенильных колец, причем преимущественно пара-положение (орто-атомы водорода одного кольца пространственно экранируют орто-положения другого кольца, что затрудняет их атаку электрофилом).
Таким образом, с учетом выше изложенных фактов, бифенил в реакциях электрофильного замещения можно приближенно рассматривать как монозамещенный бензол.
Строение ![]() -комплекса,
образующегося после атаки молекулы бифенила
электрофилом можно представить в виде
следующего набора граничных структур:
-комплекса,
образующегося после атаки молекулы бифенила
электрофилом можно представить в виде
следующего набора граничных структур:
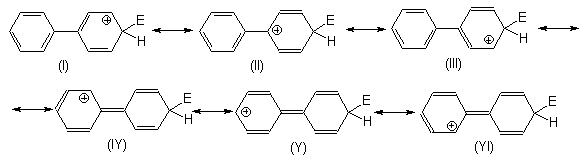
Образование резонансных структур (IY), (Y) и (YI) должно быть затруднено по следующим причинам:
С другой стороны, резонансная структура (II)
предполагает определенное участие второго
кольца в делокализации положительного заряда в ![]() -комплексе. Наиболее вероятно, что
в этом случае проявляется положительный
индуктивный, а не мезомерный (условие
образования резонансных структур IY, Y и YI) эффект
второго бензольного кольца.
-комплексе. Наиболее вероятно, что
в этом случае проявляется положительный
индуктивный, а не мезомерный (условие
образования резонансных структур IY, Y и YI) эффект
второго бензольного кольца.
При переходе от бифенила к флуорену, в котором оба бензольных кольца строго компланарны и их взаимное влияние более ярко выражено, скорость реакций электрофильного замещения резко возрастает. При этом, как правило, образуются 2-замещенные флуорены.
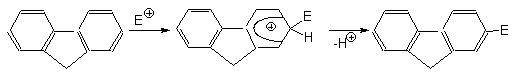
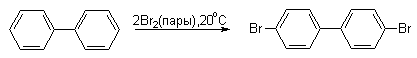
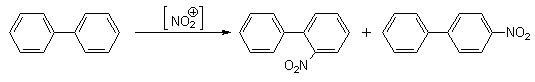
Соотношение орто- и пара-изомеров существенно зависит от условий нитрования (температуры, нитрующего агента).
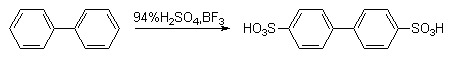
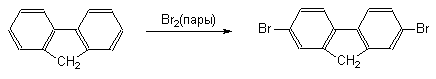
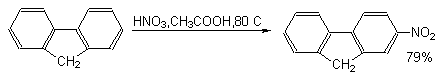
В ди- и трифенилметанах бензольные кольца полностью автономны и в реакциях электрофильного замещения они ведут себя подобно монозамещенным бензолам, содержащим объемные алкильные заместители.
2.7.2.Электрофильное замещение в конденсированных бензоидных ароматических системах
Электрофильное замещение в соединениях
данного типа также протекает с частичным
нарушением ароматической системы на стадии
образования ![]() -комплекса. Потери
энергии стабилизации в этом случае существенно
ниже, чем в случае бензола или соединений с
изолированными бензольными ядрами. Напомним
величины энергии стабилизации (кДж/моль) для
ароматических соединений, рассматриваемых в
данном разделе: бензол - 150; нафталин - 255; бифенил -
300; антрацен - 350; фенантрен - 385. Потери энергии
стабилизации (кДж/моль) при образовании
-комплекса. Потери
энергии стабилизации в этом случае существенно
ниже, чем в случае бензола или соединений с
изолированными бензольными ядрами. Напомним
величины энергии стабилизации (кДж/моль) для
ароматических соединений, рассматриваемых в
данном разделе: бензол - 150; нафталин - 255; бифенил -
300; антрацен - 350; фенантрен - 385. Потери энергии
стабилизации (кДж/моль) при образовании ![]() -комплексов и нарушении
ароматической системы в одном кольце составляют
следующие величины: бензол - 150; бифенил - 150;
нафталин - 105. Центральные ядра: антрацен - 50;
фенантрен - 50. Периферийные ядра: антрацен - 95;
фенантрен - 130. Эти цифры получены следующим
образом: например, энергия стабилизации
фенантрена равна 385 кДж/моль; после нарушения
ароматичности в центральном кольце остается
ароматическая система бифенила с энергией
стабилизации 300 кДж/моль. Следовательно, потеря
энергии стабилизации в этом случае составляет
величину 85кДж/моль (385 кДж/моль - 300 кДж/моль). При
нарушении ароматичности в периферийном кольце
фенантрена остается ароматическая система
нафталина с энергией стабилизации 255кДж/моль.
Потеря энергии стабилизации в этом случае равна
130 кДж/моль (385 кДж/моль - 255 кДж/моль).
-комплексов и нарушении
ароматической системы в одном кольце составляют
следующие величины: бензол - 150; бифенил - 150;
нафталин - 105. Центральные ядра: антрацен - 50;
фенантрен - 50. Периферийные ядра: антрацен - 95;
фенантрен - 130. Эти цифры получены следующим
образом: например, энергия стабилизации
фенантрена равна 385 кДж/моль; после нарушения
ароматичности в центральном кольце остается
ароматическая система бифенила с энергией
стабилизации 300 кДж/моль. Следовательно, потеря
энергии стабилизации в этом случае составляет
величину 85кДж/моль (385 кДж/моль - 300 кДж/моль). При
нарушении ароматичности в периферийном кольце
фенантрена остается ароматическая система
нафталина с энергией стабилизации 255кДж/моль.
Потеря энергии стабилизации в этом случае равна
130 кДж/моль (385 кДж/моль - 255 кДж/моль).
Из приведенных данных можно сделать два важных вывода:
Электрофильное замещение в нафталине приводит
к одинаковой потере энергии стабилизации (на
стадии образования ![]() -комплекса)
как при атаке электрофила в
-комплекса)
как при атаке электрофила в ![]() -
положение, так и при его атаке в
-
положение, так и при его атаке в ![]() -положение
нафталиновой системы. Однако, для аренониевого
иона, образующегося в первом случае, можно
изобразить две энергетически выгодные
резонансные структуры, тогда как во втором
случае - только одну.
-положение
нафталиновой системы. Однако, для аренониевого
иона, образующегося в первом случае, можно
изобразить две энергетически выгодные
резонансные структуры, тогда как во втором
случае - только одну.
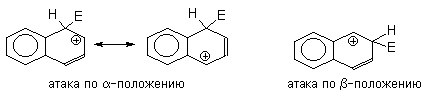
Энергетически менее выгодные резонансные
структуры, в которых нарушена ароматичность
обоих колец, мы не приводим, хотя полностью
исключить участие второго кольца в
делокализации положительного заряда в ![]() -комплексе нельзя.
-комплексе нельзя.
Электрофильное замещение в конденсированных системах может протекать как по классическому механизму SE(Ar) с образованием аренониевых ионов, так и по ионому механизму присоединения-отщепления.
Доказано, что галогенирование и нитрование антрацена в мягких условиях протекают через промежуточное образование продуктов 9,10-присоединения, которые легко превращаются в 9-производные антрацена (при избытке электрофильного реагента образуются 9,10-дизамещенные производные антрацена.
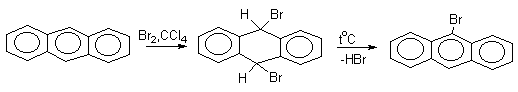
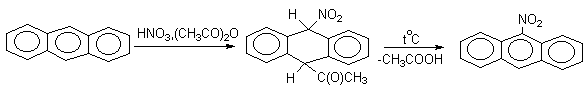
Приведенные примеры демонстрируют "диеновый" характер антрацена и его склонность к реакциям 1,4-присоединения, характерным для сопряженных диенов.
В тоже время, ацилирование антрацена проводят в условиях, типичных для процессов SE(Ar).
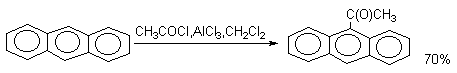
В фенантрене углерод-углеродная связь 9-10 проявляет свойства двойной связи в алкенах (гидрирование, озонолиз, галогенирование). Так, бромирование фенантрена при низкой температуре в растворе CCl4 приводит к преимущественному образованию продукта 9,10-присоединения.
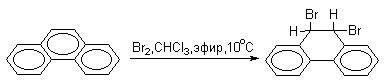
В более жестких условиях или в присутствии кислоты Льюиса образуется только 9-бромфенантрен.
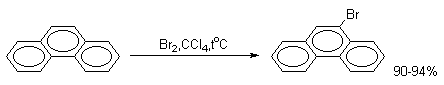
Экспериментальные данные показывают, что не всегда можно заранее предсказать результат конкретной реакции электрофильного замещения в конденсированных системах. Следует помнить, что при этом реализуются не только общие закономерности, изложенные выше, но и проявляются индивидуальные особенности каждой конденсированной системы. Например, нитрование фенантрена протекает неоднозначно и выход 9-нитрофенантрена составляет не более 35% (кроме 9-фенантрена образуются 9,10-динитрофенантрен, 1-, 2-, 3- и 4-мононитрофенантрены). Ацилирование фенантрена вообще не приводит к образованию 9-ацетилфенантрена, а протекает следующим образом:
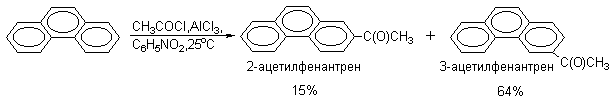
Сульфирование для этих систем (реакция обратима) протекает еще сложнее, т.к. первоначально образующиеся продукты (продукты кинетического контроля) изомеризуются в условиях реакции в более термодинамически стабильные продукты ( продукты термодинамического контроля). Более подробную информацию по электрофильному замещению в полиядерных конденсированных системах можно найти в книге Ю.С.Шабарова "Органическая химия", Москва, Химия,1994, т.2, гл.12.