Вариант 20
1. Рассмотрите систему, которая может быть либо
"пустой" при нулевой энергии, либо содержать
одну частицу в любом из двух состояний с
энергетическими уровнями E = 0 и E = ![]() . Найдите большую
статистическую сумму, среднее число частиц в
системе, числа заполнения и среднюю энергию.
. Найдите большую
статистическую сумму, среднее число частиц в
системе, числа заполнения и среднюю энергию.
2. Рассчитайте мольную изобарную теплоемкость
газообразного оксида углерода СО при T = 298K и
давлении 1 атм. Момент инерции молекулы СО равен
14.49* 10-47 кг* м2 , волновое колебательное
число ![]() =
2.170*105 м, основное электронное состояние
является невырожденным.
=
2.170*105 м, основное электронное состояние
является невырожденным.
3. Рассчитайте мольные энтропию, внутреннюю
энергию, энтальпию, свободные энергии
Гельмгольца и Гиббса газообразного оксида
углерода СО при T = 298K и давлении 1 атм. Момент
инерции молекулы СО равен 14.49*10-47 кг* м2,
волновое колебательное число ![]() = 2.170*105 м-1,
основное электронное состояние является
невырожденным.(ответ)
= 2.170*105 м-1,
основное электронное состояние является
невырожденным.(ответ)
Вариант 21
1. Найдите средние квадраты абсолютной величины угловой скорости и момента вращения молекул идеального газа Максвелла-Больцмана.
2. Рассчитайте мольные энтропию, внутреннюю энергию, энтальпию, свободные энергии Гельмгольца и Гиббса газообразного атомарного водорода при T = 298K и давлении 1 атм.
3. Рассчитайте значения стандартных
термодинамических функций (![]() G,
G, ![]() H,
H, ![]() S) и константы
равновесия газофазной реакции замещения
S) и константы
равновесия газофазной реакции замещения
HCl + Br = HBr + Cl
как функции температуры, и значения этих величин при T = 298 K. (ответ)
Вариант 22
1. Рассчитайте мольные энтропию, внутреннюю энергию, энтальпию, свободные энергии Гельмгольца и Гиббса атомарного азота при T = 298 К и давлении 1 атм.
2. Найдите химический потенциал, средние числа заполнения, внутреннюю энергию, теплоемкость идеального газа Больцмана с двумя энергетическими уровнями E0 = 0 и E1 = E и кратностями вырождения g0 и g1.
3. Рассчитайте значения стандартных
термодинамических функций (![]() G,
G, ![]() H,
H, ![]() S) и константы
равновесия Kp газофазной реакции
образования молекулы оксида азота (II) из атомов
S) и константы
равновесия Kp газофазной реакции
образования молекулы оксида азота (II) из атомов
N + O = NO
как функции температуры, и значения этих величин при T = 298 K. Используя полученный результат, найдите соответствующие величины для реакции образования оксида азота (II) из молекул азота и кислорода.(ответ)
Вариант 23
1. Воздух в комнате обьемом 3x3x3 м3 находится при обычных условиях (атмосферном давлении и температуре 300 К). Найдите вероятность того, что в какой-то момент времени обьем в 1 см3 где-нибудь внутри комнаты полностью освободится от воздуха в результате самопроизвольной статистической флюктуации.
2. Рассчитайте среднее значение <![]() N2>, используя большой
канонический ансамбль Гиббса.
N2>, используя большой
канонический ансамбль Гиббса.
3. Рассчитайте мольные энтропию, внутреннюю
энергию, энтальпию, свободные энергии
Гельмгольца и Гиббса газообразного
молекулярного иода при T = 500 K и давлении 5 атм,
для которого I = 7.64*10-45 кг* м2, ![]() = 2, n = 6.396*1012 с-1.(ответ)
= 2, n = 6.396*1012 с-1.(ответ)
Вариант 24
1. Вычислите второй вириальный
коэффициент и найдите уравнение состояния газа с
межмолекулярным взаимодействием в виде
прямоугольной потенциальной ямы: 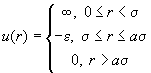
2. Найдите средний квадрат флюктуации энергии и
относительную флюктуацию энергии для квантового
гармонического осциллятора с частотой ![]() .
.
3. Рассчитайте значения стандартных
термодинамических функций (![]() G,
G, ![]() H,
H,
![]() S) и константы
равновесия газофазной реакции замещения
S) и константы
равновесия газофазной реакции замещения
HF + Br = HBr + F
как функции температуры, и значения этих величин при T = 298 K.(ответ)
Вариант 25
1. Пусть некоторая молекула существует в трех
состояниях с энергиями, равными 0, ![]() и
и ![]() . Найдите
выражение для молекулярной суммы по состояниям Q
и выражения для мольных внутренней энергии и
изохорной теплоемкости.
. Найдите
выражение для молекулярной суммы по состояниям Q
и выражения для мольных внутренней энергии и
изохорной теплоемкости.
2. Вычислите второй вириальный
коэффициент и найдите уравнение состояния газа
жестких сферических молекул со слабым
притяжением (потенциал взаимодействия
Сазерленда):![]()
3. Рассчитайте значения стандартных
термодинамических функций (![]() G0,
G0, ![]() H0,
H0, ![]() S0)
и константы равновесия Kp газофазной
реакции замещения
S0)
и константы равновесия Kp газофазной
реакции замещения
HF + I = HBr + I
как функции температуры, и значения этих величин при T = 298 K. (ответ)