|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[предыдущий раздел] [содержание] [следующий
раздел]
§ 11. Свойства оксокислот халькогенов
(IV).
Сила кислот (в свободном состоянии выделена
лишь Н2SeO3, свойства Н2SO3
и Н2TeO3, оцениваются по
свойствам соответствующих полей)
уменьшается в ряду Н2SO3 - Н2SeO3
- Н2TeO3 (табл.8). По мере роста радиуса и
уменьшения электроотрицательности атом
халькогена слабее смещает электронную плотность
от атома кислорода гидроксильной группы и тем
самым слабее поляризует связь О-Н.
Таблица 8.Свойства кислот Н2ЭО3
| |
Н2SO3 |
Н2SeO3 |
Н2 TeO3 |
pK1 Н2ЭО3= H+
+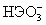 pK2
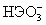 = H+
+ = H+
+ 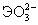
Ео, В (рН=0): Н2ЭО3+4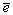 +4Н+=Э+3Н2О +4Н+=Э+3Н2О
(рН=14): 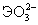 +4 +4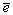 +3Н2О=Э+6ОН- +3Н2О=Э+6ОН- |
1.9
7.7
0.45
-0.66 |
2.6
8.3
0.74
-0.34 |
2.7
8.0
0.56
-0.41 |
Интересной особенностью соединений S(IV)
является их таутомерия, то есть
существование изомеров одинакового состава, но
разного строения:
| H - SO3 - |
|
H - OSO2- |
| I |
|
II |
В изомере I атом водорода связан с атомом серы, а
в изомере II - с атомом кислорода. Изомер I
обнаружен рентгенографически в солях RbHSO3 и
CsHSO3. В концентрированных растворах
гидросульфитов образуются пиросульфиты: 2HSO3
- [O2S-SO3]2-
+ H2O, в которых реализуется связь S- S,
а не - S- O- S- . Для гидроселенитов таутомерия не
характерна, и они существуют в форме II. [O2S-SO3]2-
+ H2O, в которых реализуется связь S- S,
а не - S- O- S- . Для гидроселенитов таутомерия не
характерна, и они существуют в форме II.
Сера (IV) в сульфит-ионе может переходить в
более высокую и более низкую степени окисления,
то есть выступает в качестве восстановителя и
окислителя, соответственно. Значения
стандартных электродных потенциалов для реакций
Э(IV) приведены в табл.8. При нагревании твердые
сульфиты щелочных металлов диспропорционируют
(при нагревании в вакууме твердые сульфиты Ca,
Sr, Ba разлагаются до соответствующих
оксидов. MSO3 = MO + SO2, а на воздухе -
окисляются до сульфатов)
4Na2SO3 3Na2SO4 + Na2S. 3Na2SO4 + Na2S.
В отличие от селенитов и теллуритов сернистая
кислота и ее соли обладают выраженными
восстановительными свойствами. Сульфиты в
водных растворах медленно окисляются кислородом
воздуха: 2SO32- + О2  SO42- (аналогичная
реакция, катализируемая оксидом азота NO, в
атмосфере служит источником кислотных дождей). SO42- (аналогичная
реакция, катализируемая оксидом азота NO, в
атмосфере служит источником кислотных дождей).
Сернистая кислота действует как мягкий
восстановитель в многочисленных реакциях с
солями металлов:
Fe2(SO4)3 + SO2 + 2H2O  2FeSO4 + 2H2SO4 2FeSO4 + 2H2SO4
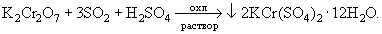
У селенистой и теллуристой кислот
восстановительные свойства выражены слабее
(табл.8), то есть окислить их до производных Se(VI) и
Te(VI) значительно труднее.
Отметим, что механизм
окислительно-восстановительных реакций может
включать прямой перенос атомов кислорода от
окислителя к восстановителю. Например, при
изучении в щелочной среде кинетики окисления
сульфит-иона SO32- перманганат-ионом с
помощью стабильного изотопа 18О было
установлено, что содержание 18О в
образующемся сульфат-ионе
SO32- + 18ОMnO32-  O3S18O2- +
Mn O32- O3S18O2- +
Mn O32-
такое же, как в исходном перманганат-ионе. Это
означает, что происходит прямой перенос атома
кислорода от MnO4- к SO32- ,
сопровождающийся одновременным переходом двух
электронов.
При взаимодействии с более сильными
восстановителями соединения S(IV) проявляют
окислительные свойства, например, SO2 + 2H2S
3S + 2H2O или SO2+ 3Zn + 6H+  H2S H2S  + 3Zn2+ + 2H2O . + 3Zn2+ + 2H2O .
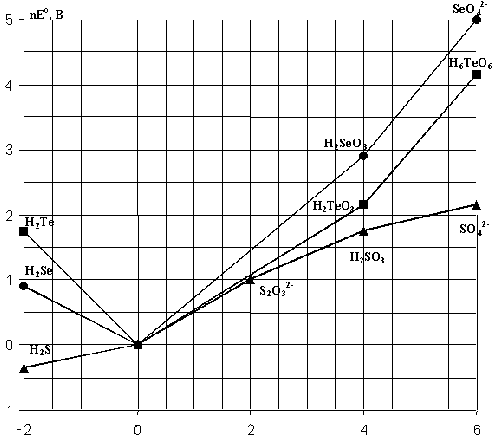
Рис.7. Диаграмма окислительных состояний
соединений халькогенов (рН=0).
Из рис.7 и табл.8 видно, что окислительные
свойства H2TeO3 выражены сильнее, чем у
сернистой кислоты. Соединения Se(IV) проявляют
более сильные окислительные свойства, чем
соединения S(IV) и Te(IV). Например, водный раствор
SO2 восстанавливает селенистую кислоту: H2SeO3
+ 2 SO2 + H2O  Se
Se  + 2H2SO4 .
Аналогично протекает реакция с H2TeO3 . + 2H2SO4 .
Аналогично протекает реакция с H2TeO3 .
Как следует из диаграммы окислительных
состояний (рис.7), термодинамическая
стабильность оксокислот H2ЭO3 по
отношению к диспропорционированию на Эо
и ЭО2-4 увеличивается в ряду H2TeO3>H2SeO3>>H2SO3.
Действительно, вольт-эквивалент (nEo)
сернистой кислоты лежит выше, а селенистой и
теллуристой кислот - ниже линии, соединяющей
вольт-эквиваленты частиц Эо и ЭО2-4.
Так как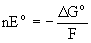 , где , где  Go - энергия
Гиббса превращения ЭО2-3 в Эо и
ЭО42- , n - количество
электронов, участвующих в этом процессе, F - число
Фарадея, Ео - стандартный потенциал, то
указанное взаимное положение вольт-эквивалентов
означает, что равновесие Go - энергия
Гиббса превращения ЭО2-3 в Эо и
ЭО42- , n - количество
электронов, участвующих в этом процессе, F - число
Фарадея, Ео - стандартный потенциал, то
указанное взаимное положение вольт-эквивалентов
означает, что равновесие
3Н2ЭО3 = Э + ЭО2-4 + Н2О +
4Н+ в случае Э = S смещено вправо, а при Э = Sе и
Те - влево.
[предыдущий раздел] [содержание] [следующий
раздел]
|

