|
Учебные материалы по физической химии
Реальные газы
1.5. Закон соответственных
состояний
Поскольку критические константы являются
характеристическими свойствами газов, их можно
использовать для создания соответствующей
относительной шкалы, введя безразмерные приведенные
переменные: приведенное давление pr,
приведенный объем Vr и приведенную
температуру Tr:
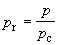 , , 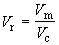 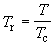 . (1.22) . (1.22)
Соответственными называются состояния разных
веществ, имеющие одинаковые значения
приведенных переменных. Согласно закону
соответственных состояний, если для
рассматриваемых веществ значения двух
приведенных переменных одинаковы, должны
совпадать и значения третьей приведенной
переменной. Таким образом, уравнения состояния
различных веществ, записанные в приведенных
переменных, должны совпадать. Это утверждение
эквивалентно постулату о существовании общего
универсального приведенного уравнения
состояния
F(pr, Vr, Tr)
= 0 (1.23)
Поскольку это приведенное уравнение не
содержит в явном виде индивидуальных постоянных,
оно должно быть применимо к любому веществу.
Закон соответственных состояний является общим
утверждением, не связанным с конкретным видом
уравнения состояния. На практике закон
соответственных состояний приближенно
выполняется для однотипных веществ, что
позволяет, например, использовать для реальных
газов обобщенные диаграммы сжимаемости (рис. 1.6).
|
Рис.1.6. Зависимость фактора
сжимаемости некоторых газов от приведенного
давления при разных приведенных температурах. |
Уравнение Ван-дер-Ваальса также согласуется с
законом соответственных состояний. Подставляя в
исходное уравнение (1.5) постоянные a, b и R,
выраженные через критические параметры
(уравнения (1.11) – (1.13)), и переходя к приведенным
переменным, получим уравнение Ван-дер-Ваальса в
приведенной форме:
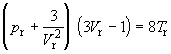 . (1.24) . (1.24)
Можно показать, что любое уравнение состояния,
содержащее три параметра, можно представить в
приведенной форме. В таблице 1.4 представлены
наиболее известные уравнения состояния. Для тех
из них, которые содержат три параметра,
представлена также и приведенная форма.
Отсутствие универсального уравнения F(pr,
Vr, Tr) = 0 говорит не о
неверности закона о соответственных
состояниях, а о недостаточности двух
индивидуальных постоянных и R в уравнении
состояния.
В настоящее время понятно, почему в уравнениях
состояния реальных газов двух индивидуальных
параметров в общем случае не хватает, но в первом
приближении этого достаточно. Причиной всех
отклонений от уравнения состояния идеального
газа являются межмолекулярные взаимодействия в
газах. Зависимость потенциала межмолекулярного
взаимодействия u от расстояния между
частицами r достаточно точно описывается
уравнениями, содержащими по меньшей мере четыре
параметра – n, m, A и B:
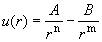 . (1.25) . (1.25)
Статистический расчет показывает, что наличие
индивидуальных постоянных в уравнении
межмолекулярного взаимодействия всегда
приводит к появлению индивидуальных постоянных
и в уравнении состояния газов. Поэтому в области
значений p, V и T, для которых в реальных
газах вклад межмолекулярных взаимодействий
достаточно велик, в уравнениях состояния
появляются индивидуальные постоянные, зависящие
от параметров уравнении межмолекулярного
взаимодействия. Вместе с тем для молекул
сфероидальной формы довольно хорошие результаты
дает уравнение с n = 12 и m = 6. Поэтому в
приближенных уравнениях состояния часто
оказывается достаточно использовать две
индивидуальные постоянные. Если же требуется
описать поведение газа с более высокой
точностью, необходимо использовать уравнения с
бу льшим числом постоянных. Так, например,
уравнение Битти – Бриджмена (см. табл. 1.4)
содержит пять постоянных кроме R и считается
одним из лучших эмпирических уравнений
состояния. В течение некоторого времени оно
применялось при составлении справочных таблиц
реальных газов. В настоящее время для возможно
более точного описания свойств газов используют
эмпирическое уравнение Бенедикта – Вебба –
Рубина (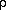 - плотность газа): - плотность газа):
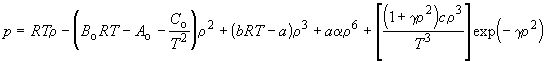 . .
|

