


Ткани и органы. Печень
Метаболизм липидов
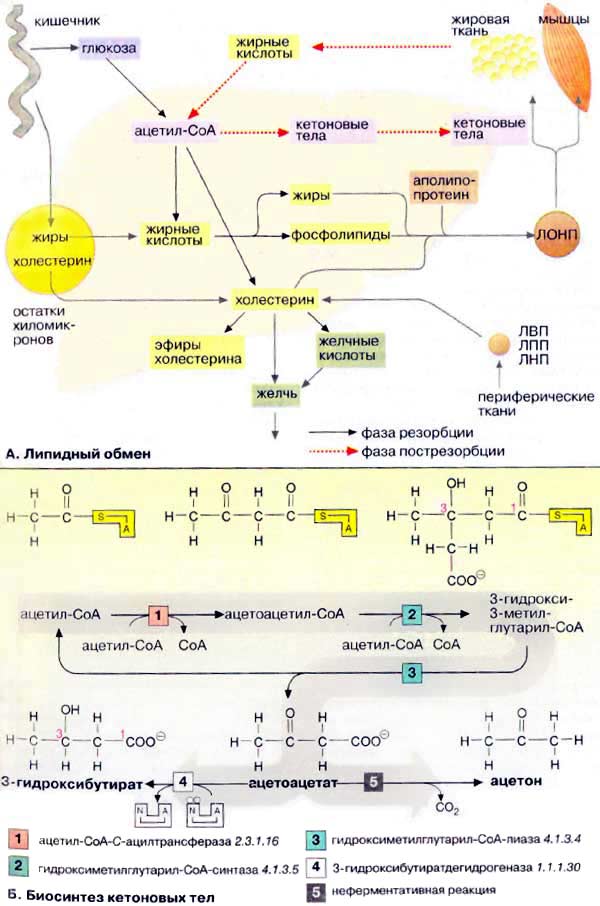 Печень является главным местом синтеза
жирных кислот, жиров, кетоновых тел и холестерина. Жиры могут
также синтезироваться в жировой ткани, однако ее основной функцией остается
депонирование липидов.
Печень является главным местом синтеза
жирных кислот, жиров, кетоновых тел и холестерина. Жиры могут
также синтезироваться в жировой ткани, однако ее основной функцией остается
депонирование липидов.
А. Метаболизм
липидов
Обмен липидов в печени тесно связан с
превращением углеводов и аминокислот. При поступлении питательных веществ в
фазе резорбции (см. с. 300) глюкоза через промежуточное образование
ацетил-КоА (ацетил-СоА) конвертируется в жирные кислоты. Печень может
также извлекать жирные кислоты из липопротеинов, поступающих из
желудочно-кишечного тракта (в виде хиломикронов) и других тканей (см. с.
272). Жирные кислоты используются для биосинтеза триглицеринов и
фосфолипидов. При связывании жиров с аполипопротеинами образуются
липопротеиновые комплексы очень низкой плотности [ЛОНП (VLDL), см. с. 272]. Они
попадают в кровь и переносятся в другие ткани, прежде всего в жировую и мышечную
ткань.
В фазе пострезорбции (см. с. 300),
особенно в период поста или голодания, обмен липидов идет в обратном
направлении, организм обращается к собственным запасам. В этих условиях жиры
поступают из жировой ткани в кровь, переносятся в печень, распадаются в
результате β-окисления до ацетил-КоА и, наконец, превращаются в кетоновые
тела.
Холестерин поступает в организм
из двух источников — с пищей и за счет эндогенного синтеза, причем большая часть
холестерина синтезируется в печени. Биосинтез холестерина начинается с
ацетил-КоА (см. с. 174). Полученный холестерин используется в синтезе желчных
кислот (см. с. 306), встраивается в клеточные мембраны (см. с. 216),
депонируется в жировых каплях в составе эфиров жирных кислот. Остальная часть
поступает в кровь в составе липопротеиновых комплексов [ЛОНП (VLDL)] и
переносится в другие ткани. Печень способствует обмену холестерина благодаря
тому, что служит местом, худа поступают с кровью и где подвергаются расщеплению
липопротеиновые комплексы [ЛВП, ЛПП, ЛНН (HDL, IDL, LDL), см. с. 272],
содержащие холестерин и его эфиры с жирными кислотами.
Б. Биосинтез кетоновых
тел
При высокой концентрации ацетил-КоА в
митохондриях гепатоцитов происходит конденсация двух молекул ацетил-КоА с
образованием ацетоацетил-КоА [1]. Присоединение еще одной ацетильной
группы [2] приводит к 3-гидрокси-З-метилглутарил-КоА (ГМГ-КоА) [3], который
после отщепления ацетил-КоА превращается в ацетоуксусную кислоту (ацетоацетат)
(цикл Линена). При восстановлении последней получается
3-гидроксибутират [4], а при неферментативном декарбоксилировании —
ацетон [5]. Все три соединения принято называть «кетоновыми телами», что
не совсем правильно, поскольку в 3-гидроксимасляной кислоте отсутствует
кетогруппа!
Кетоновые тела поступают из печени в
кровь, где они хорошо растворимы. Концентрация кетоновых тел в крови возрастает
в фазе пострезорбции (фаза голодания). Наряду с жирными кислотами
3-гидроксибутират и ацетоацетат в этот период являются основными
энергоносителями. Ацетон, не имеющий метаболической ценности, удаляется через
легкие. После 1-2 недели голодания кетоновые тела начинают использоваться в
качестве источника энергии нервными тканями. Однако при этом для обеспечения
цитратного цикла необходимо минимальное количество глюкозы.
Если биосинтез кетоновых тел превышает
потребности организма, они накапливаются в крови (кетонемия) и, наконец,
выводятся с мочой (кетонурия). Оба феномена наблюдаются во время
длительного голодания (углеводная недостаточность) и при заболеваний диабетом
(Diabetes mellitis). Хотя 3-гидроксимасляная кислота является слабой
кислотой (рКа примерно 4), возрастание концентрации кетоновых тел
вызывает изменение рН в крови (кетоацидоз, см. с. 280). Кетонурия и
кетоацидоз могут быстро привести к электролитному сдвигу (нарушению ионного
гомеостаза) и потери сознания (кетоацидозной коме) и, следовательно,
опасны для жизни.