


Ткани и органы. Иммунная система
Биосинтез антител
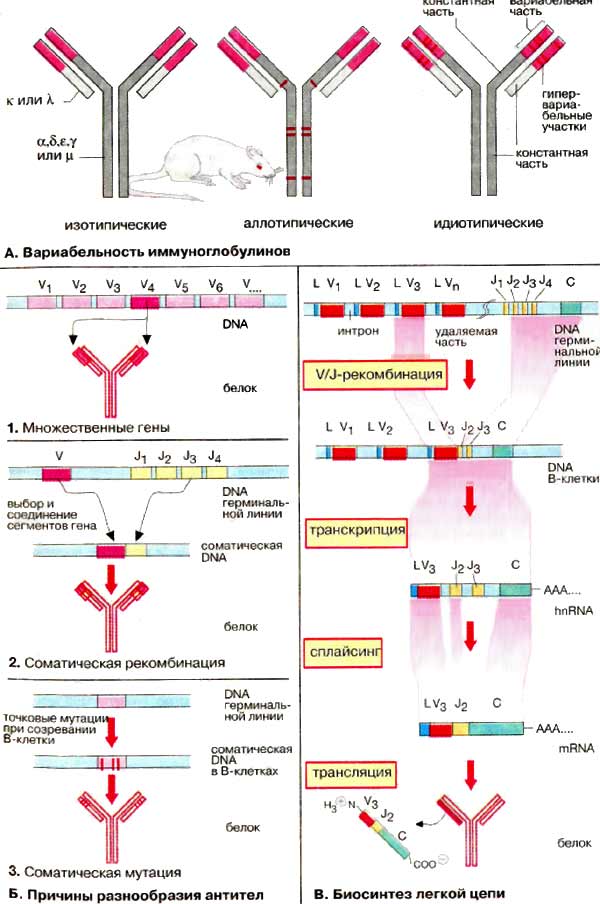 А. Вариабельность
иммуноглобулинов
А. Вариабельность
иммуноглобулинов
Несмотря на сходство своей основной
структуры иммуноглобулины (Ig) чрезвычайно разнообразны. Считается, что в
организме человека имеется примерно 108 различных вариантов антител.
Вариабельность Ig относится как к легким, так и тяжелым
цепям.
Имеется пять разновидностей тяжелых
H-цепей (α, β, ε, γ и μ, см. с. 288), которые и определяют классы антител, и две
разновидности легких L-цепей (κ и λ). Эти типы вариаций называют
изотопическими. При биосинтезе Ig может происходить переключение
плазматических клеток с продукции одного изотипа на другой («переключение
генов»). Аллотипические вариации относятся к вариабельности аллелей в
пределах вида, т. е. к генетически определяемым различиям одного индивидуума от
другого. Идиотипические вариации определяют различия в антигенсвязывающем
участке антител, Они касаются вариабельных доменов (на схеме розового
цвета) легкой и тяжелой цепей. Некоторые их участки являются
гипервариабельными (красного цвета на рисунке), т.е. их отличия особенно
велики. Эти последовательности непосредственно участвуют в связывании
антигена.
Б. Причины разнообразия антител
Исключительная вариабельность антител
обусловлена тремя причинами.
1. Множественность генов. Имеется
множество генов, кодирующих белки вариабельных доменов, однако выбирается и
экспрессируется только один ген.
2. Соматические рекомбинации.
Гены разделены на несколько сегментов, для которых имеются различные версии. Во
время созревания В-клеток благодаря случайной комбинации сегментов возникают
новые гены (мозаичные гены).
3. Соматические мутации.
Во время дифференциации В-клеток и превращения в плазматические клетки
происходят мутации в кодирующих генах. Таким образом, изначальные гены
терминальной линии могут стать различными соматическими генами в
индивидуальных клонах В-клеток.
В. Биосинтез легкой цепи
Рассмотрим основные особенности
организации гена иммуноглобулина и его экспрессии на примере биосинтеза мышиной
κ-цепи. Сегменты гена, кодирующие эту легкую цепь, обозначаются как L, V, J и С.
Они локализованы на хромосоме 6 в ДНК (DNA) терминальной линии клеток
мыши (у человека на хромосоме 2) и разделены друг от друга интронами различной
длины.
Примерно 150 идентичных сегментов
L гена кодируют сигнальный пептид (17-20 аминокислот) для секреции продукта
(см. рис. 233). Наибольшая часть вариабельного домена (95 из 108 аминокислотных
остатков) кодируется около 150 различными V-сегментами,
расположенными рядом с L-сегментом. L- и V-сегменты всегда расположены парами,
так называемым тандемом. Напротив, для J-сегмента (от англ. joining)
существует максимально только пять вариантов. Они кодируют пептид из 13
аминокислотных остатков, который связывает вариабельную и константную части
κ-цепи. Константная часть легкой цепи (84 аминокислоты) кодируется единственным
С-сегментом.
Во время дифференциации В-лимфоцитов
уникальная V/J-комбинация возникает в каждой В-клетке. Один из 150
сегментов L-V-тандема выбирается и связывается с одним из пяти J-сегментов. Это
приводит к возникновению соматического гена, который значительно меньше
по сравнению с геном терминальной линии. Транскрипция этого гена ведет к
образованию гяРНК (hnRNA) для κ-цепи. Из этой РНК удаляются путем
сплайсинга интроны и лишние J-сегменты (см. рис. 243). Зрелая мРНК (mRNA)
содержит сегменты L-V-J-C и после транспорта в цитоплазму готова для трансляции.
Последующие шаги биосинтеза Ig те же, что и для других мембранных или
секреторных белков (см. рис. 233).