ВАРИАНТЫ С РЕШЕНИЯМИ
Вариант 20
1. Для одного моля некоторого газа известны
значения частных производных внутренней энергии
и энтропии по объему при постоянной температуре:
(![]() U/
U/![]() V)T = a/V,
(
V)T = a/V,
(![]() S/
S/![]() V)Т = R/(V-
b), a, b - индивидуальные постоянные газа. Используя
уравнение Максвелла, установите уравнение
состояние этого газа.
V)Т = R/(V-
b), a, b - индивидуальные постоянные газа. Используя
уравнение Максвелла, установите уравнение
состояние этого газа.
2. Получите выражение для разности теплоемкостей СP - СV для любой системы и, в частном случае, для идеального газа.
3. Почему твердый углекислый газ при обычных условиях испаряется, а лед плавится?
4. Зависимость давления насыщенного пара (идеальный газ) над некоторой жидкостью от температуры выражается уравнением:
ln Р (атм) = A - B/T - C ln T + DT (A, B, C, D - положительные
постоянные величины). Известна стандартная
мольная энтропия жидкости ![]() (ж) при температуре TХ < TН.Т.К..
Как, используя эти данные, можно рассчитать
стандартную мольную энтропию пара при
температуре TХ:
(ж) при температуре TХ < TН.Т.К..
Как, используя эти данные, можно рассчитать
стандартную мольную энтропию пара при
температуре TХ: ![]() (пар)
(Р = 1 атм)?
(пар)
(Р = 1 атм)?
5. Показать, что для идеальных растворов двух
летучих жидкостей А и В суммарное давление пара:
Р = РА + РВ = ![]() + xB(
+ xB(![]() -
- ![]() ), где
), где ![]() и
и ![]() - давления
пара над чистыми жидкостями, xB - мольная
доля вещества В.
- давления
пара над чистыми жидкостями, xB - мольная
доля вещества В.
6. Для определения рН некоторого раствора в горных условиях при 298 К применяется электрохимическая ячейка, включающая водородный электрод и каломельный полуэлемент. С ее помощью на равнине (Р (Н2) = 1 атм) установлено некоторое значение рН. Принимая во внимание, что давление водорода изменяется с высотой в соответствии с барометрической формулой: Р = Р0exp (- Mgh/RT), где M - молекулярная масса газа, h - высота, Р0 - давление газа на уровне h = 0, g - ускорение свободного падения, выведите формулу для расчета рН на произвольной высоте h.
7. Необратимая реакция имеет целочисленный
порядок в интервале от одного до трех. Отношение
времен превращения на кратную часть ![]() 1/2:
1/2: ![]() 3/4 =
0,2, где
3/4 =
0,2, где ![]() 1/2 и
1/2 и ![]() 3/4 время превращения реагента на 50 и 75%
соответственно. Чему равен порядок этой реакции?
3/4 время превращения реагента на 50 и 75%
соответственно. Чему равен порядок этой реакции?
Решение варианта 20
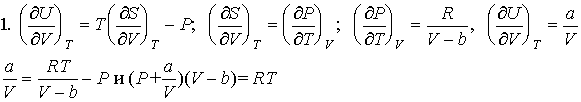
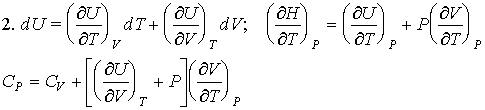
3. Тройная точка для воды находится при давлении 4,58 мм рт.ст. и температуре 0,010 С, а для СО2 при давлении 5,11 атм и температуре -56,60 С. Поэтому в комнате при температуре 18-200 С и давлении ~ 1 атм лед плавится, а твердый СО2 испаряется.
4. По уравнению Клаузиуса-Клапейрона изменение энтропии в ходе равновесного фазового перехода под давлением насыщенного пара при температуре ТХ:
d ln P/dT = D S/RT = B/T2 -C/T + D; D ![]() = R{B/TX - C +DTX}.
= R{B/TX - C +DTX}.
Равновесное давление пара над жидкостью при температуре ТХ равно
![]() = exp{A - B/TX
- C ln TX + DTX}.
= exp{A - B/TX
- C ln TX + DTX}.
Стандартная энтропия пара равна сумме
стандартной энтропии жидкости, изменения
энтропии в ходе равновесного фазового перехода и
изменения энтропии при сжатии пара от давления ![]() до 1 атм:
до 1 атм:
![]() (пар) =
(пар) = ![]() (ж) + D
(ж) + D![]() - R ln (1/
- R ln (1/![]() )
)
5. По закону Рауля: РА = ![]() хА, РВ =
хА, РВ = ![]() хВ; хА + хВ
= 1, откуда
хВ; хА + хВ
= 1, откуда
Р = РА + РВ = ![]() + xB(
+ xB(![]() -
-
![]() )
)
6. Схема гальванического элемента имеет вид:
Pt | H2 | испытуемый р-р || KCl || KCl (водн. р- р) | Hg2Cl2 (тв) | Hg (ж) |Pt
насыщ. станд. ![]()
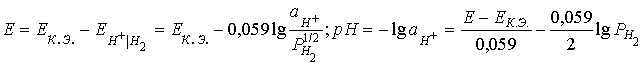
![]()
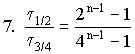 . Подбором
определяем при n = 3, t 1/2:t 3/4 = 0,2.
. Подбором
определяем при n = 3, t 1/2:t 3/4 = 0,2.