Варианты письменного зачёта
Вариант 2
1. Каким процессам соответствует стандартная энтальпия образования и стандартная энтальпия сгорания молочной кислоты? Запишите соответствующие уравнения реакций.
2. Используя уравнение Больцмана рассчитать число микросостояний и энтропию кристалла NaF (0,1 моля) при 0 К, если а) кристалл идеален и не содержит примесей, б) кристалл содержит 1 атом К и один атом Cl , замещающие атомы натрия и фтора в его структуре.
3. Для гипотетической химической
реакции ![]() r Н0 следующим
образом зависит от температуры:
r Н0 следующим
образом зависит от температуры:
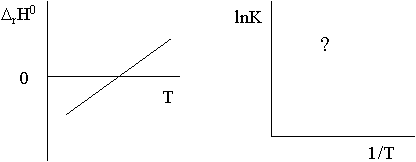
Изобразите зависимость константы равновесия для этой реакции от температуры в координатах ln К = f (1/Т).
4. В электрохимической цепи возможны следующие реакции на электродах:
(1) О2 + 2Н2 О + 4е = 4ОН - (Е01 = 0,401 В) и
(2) AgCl +е = Ag + Cl - (Е02 = 0,222 В)
Запишите схему электрохимической цепи, составленной из этих электродов. Запишите уравнение Нернста для этой цепи. Рассчитайте, при каком давлении кислорода может происходить восстановительный процесс на хлорсеребряном электроде.
5. В области температур от 0 до 12 К
теплоемкость серебра хорошо описывается по
"закону кубов" Дебая С V = ![]() Т3,
причем известно экспериментальное значение
теплоемкости серебра при 12 К СP (12
К). Как рассчитать изменение энтальпии и энтропии
серебра при нагревании от 0 до 12 К. Можно ли
рассчитать Н (12 К) и S (12 К) для серебра?
Т3,
причем известно экспериментальное значение
теплоемкости серебра при 12 К СP (12
К). Как рассчитать изменение энтальпии и энтропии
серебра при нагревании от 0 до 12 К. Можно ли
рассчитать Н (12 К) и S (12 К) для серебра?
6. Движение (транспорт) воды по стволу деревьев от корней до вершины "обеспечивает" одно из коллигативных свойств растворов. Какое?
7. Рассчитать отношение скоростей
превращения вещества А по реакции второго
порядка при увеличении температуры от 27 до 370С,
если температурный коэффициент константы
скорости ![]() равен 2, а начальные
концентрации вещества А равны 2 моль/л при 270С
и 1 моль/л при 370С.
равен 2, а начальные
концентрации вещества А равны 2 моль/л при 270С
и 1 моль/л при 370С.