Решение варианта 6
1. Экспериментально определяется ![]() сUT глицина в
кислороде (при повышенном давлении О2 для
обеспечения полноты сгорания), из этих данных
находят
сUT глицина в
кислороде (при повышенном давлении О2 для
обеспечения полноты сгорания), из этих данных
находят ![]() сU0T
сU0T
NH2CH2COOH (тв) + 2.25О2 (г) = 2СО2 (г) + 2.5Н2О (ж) + 0.5N2 (г),
![]() сН0Т =
сН0Т = ![]() сU0Т + 0.25. RT,
принимая, что газы идеальные,
сU0Т + 0.25. RT,
принимая, что газы идеальные,
![]() fH0Т (С2Н5О2N)
= -
fH0Т (С2Н5О2N)
= - ![]() cH0Т (С2Н5О2N)
+ 2
cH0Т (С2Н5О2N)
+ 2![]() fH0Т (CO2)
+ 2.5
fH0Т (CO2)
+ 2.5![]() fH0Т (H2O)
(ж).
fH0Т (H2O)
(ж).
2. ![]() H = nCР(T2- T1),
H = nCР(T2- T1),
![]() S = nCРln T2/T1,
S = nCРln T2/T1,
![]() G =
G = ![]() H -
H - ![]() (TS) =
(TS) = ![]() H - T2ST2
+ T1ST1 =
H - T2ST2
+ T1ST1 = ![]() H - T2(nS0T1
+
H - T2(nS0T1
+ ![]() S) + T1nS0T1.
S) + T1nS0T1.
Из справочника надо взять S0T1 для водорода и принять, что для водорода СP = 3.5R.
3. ![]() H = RT2(d ln P/dT)=2.303bR - cRT;
H = RT2(d ln P/dT)=2.303bR - cRT; ![]() S = RT(d lnP/dT) = 2.303bR/T - cR.
S = RT(d lnP/dT) = 2.303bR/T - cR.
4. (d ln KP/d T)P = ![]() Н/RT2,
Н/RT2, ![]() Н > 0, с ростом температуры выход
циклогексана увеличится; (d ln KN/d P)T = -
Н > 0, с ростом температуры выход
циклогексана увеличится; (d ln KN/d P)T = -
![]() n
/р,
n
/р, ![]() n < 0, выход продукта с ростом общего
давления в системе увеличивается, если принять,
что газы идеальные.
n < 0, выход продукта с ростом общего
давления в системе увеличивается, если принять,
что газы идеальные.
5. ![]() 2 (сим) = P2/P02х2;
2 (сим) = P2/P02х2;
![]() 2 (несим) = P2/КГ2х2;
2 (несим) = P2/КГ2х2;
![]() 2 (сим)/
2 (сим)/![]() 2
(несим) = КГ2/Р02, от состава
раствора это соотношение не зависит.
2
(несим) = КГ2/Р02, от состава
раствора это соотношение не зависит.
6. Pt | H2 | НBr (водный р-р) | AgBr | Ag | Pt
На правом электроде: AgBr + e ![]() Ag + Br-
Ag + Br-
На левом электроде: 0.5Н2 - е ![]() Н+
Н+
![]()
![]() по первому
приближению теории Дебая-Хюккеля; рассматривая
зависимость
по первому
приближению теории Дебая-Хюккеля; рассматривая
зависимость ![]() от m
от m![]() 1/2,(m
1/2,(m![]() равна
моляльной концентрации m раствора НВr), при m
равна
моляльной концентрации m раствора НВr), при m ![]() 0,
0,
g ![]()
![]() 1,
получаем значение Е0.
1,
получаем значение Е0.
7. Время превращения вещества связано с
отношением текущей концентрации С к начальной
концентрации С0 ![]() = C/C0
и равно:
= C/C0
и равно:
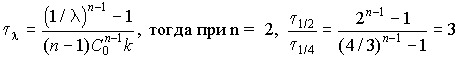 .
.
Решение варианта 7
1. ![]() U =
U = ![]() H -
H - ![]() n RT, газы идеальные; не учитывается
изменение объема для конденсированных фаз;
n RT, газы идеальные; не учитывается
изменение объема для конденсированных фаз;
![]()
![]() > 0,
> 0, ![]() U <
U < ![]() H,
например: СО(NH2)2 (тв.) + Н2О (ж) = СО2
(г) + 2NH3 (г),
H,
например: СО(NH2)2 (тв.) + Н2О (ж) = СО2
(г) + 2NH3 (г),
![]()
![]() = 3;
= 3;
![]()
![]() = 0,
= 0, ![]() U =
U = ![]() H, например: С6Н12О6
(тв.) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
H, например: С6Н12О6
(тв.) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
2. CV = 2.5R; CP = 3.5R; ![]() =
CP/CV = 1.4
=
CP/CV = 1.4
T2 = T1[P1/P2](1/![]() - 1),
- 1), ![]() Т = Т2
- Т1,
Т = Т2
- Т1,
D U = nCV![]() Т;
Т; ![]() H = nCP
H = nCP![]() Т;
Т; ![]() S = 0;
S = 0; ![]() F =
F = ![]() U - n
U - n![]() Т. S0Т1;
Т. S0Т1;
![]() G =
G = ![]() H -
H - ![]() Т nS0Т1,
Т nS0Т1,
из справочника нужно взять значение S0Т1 кислорода.
3. Согласно уравнению Клаузиуса-Клапейрона
при изменении температуры фазового перехода
изменяется и давление, при котором он происходит.
Однако для приближенной оценки энтальпии
испарения ![]() VH можно
использовать формулу Кирхгофа: (d
VH можно
использовать формулу Кирхгофа: (d ![]() VH/dT)P
VH/dT)P ![]()
![]() CP;
поскольку
CP;
поскольку ![]() CP < 0, то
энтальпия испарения с увеличением температуры
будет уменьшаться:
CP < 0, то
энтальпия испарения с увеличением температуры
будет уменьшаться: ![]() VH383
VH383
![]()
![]() VH373
+
VH373
+ ![]() CР
CР![]() Т
Т![]() 9710 - 96 = 9614 (кал/моль).
9710 - 96 = 9614 (кал/моль).
4. ![]() H = RT2(d ln KР/dT)Р
= 2.303Rb, т.е. не зависит от температуры.
H = RT2(d ln KР/dT)Р
= 2.303Rb, т.е. не зависит от температуры.
(dln KN/dP)T = -![]()
![]() /р,
/р, ![]()
![]() = 0, т.е. выход продуктов не
изменится при увеличении общего давления, если
газы идеальные.
= 0, т.е. выход продуктов не
изменится при увеличении общего давления, если
газы идеальные.
5. ![]() T = E. m, где m -
моляльность раствора, E = M1RT12/
T = E. m, где m -
моляльность раствора, E = M1RT12/![]() H, тогда
H, тогда
М2 = g2M1RT121000/g1![]() T.
T. ![]() H, при
условии, что растворенное вещество при Т2
нелетуче. Раствор должен быть идеальным или
разбавленным.
H, при
условии, что растворенное вещество при Т2
нелетуче. Раствор должен быть идеальным или
разбавленным.
6.
| Pt| Н2 |НСl | (водный р- р) || |
NiCl2 (водный р- р) | | Ni | Pt |
|
|
На правом электроде: Ni2+ +2е ![]() Ni
Ni
На левом электроде: Н2 - 2e ![]() 2Н+
2Н+
Реакция в гальваническом элементе: Ni2+ + Н2=2Н++Ni
![]() = -
= - ![]() rG0/nF
= - (
rG0/nF
= - (![]() rH0 - 298.
rH0 - 298. ![]() rS0)/2F,
rS0)/2F, ![]() rH0 = -
rH0 = - ![]() fH0 (Ni2+(р-
р));
fH0 (Ni2+(р-
р)); ![]() rS0 = S0 (Ni (тв.))
- . S0 (Н2 (г)) - S0 (Ni2+ (р-
р))
rS0 = S0 (Ni (тв.))
- . S0 (Н2 (г)) - S0 (Ni2+ (р-
р))
7. Пусть скорость реакции изменилась в 2 раза
при увеличении
температуры от 298 до 308 К, тогда: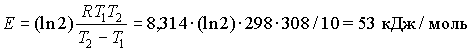 .
.