Раздел 7. Растворы неэлектролитов.
1. Изобразите зависимость общего давления от состава жидкого двухкомпонентного раствора и состава равновесного с ним пара при температуре Т, если раствор идеальный. Укажите области на диаграмме, где в равновесии находятся жидкость и пар, только пар, только жидкость. Приведите примеры "точек" на этой диаграмме, для которых число степеней свободы равно а) 0, б) 1, в) 2.
2. Изобразите зависимость температуры кипения от состава жидкого двухкомпонентного раствора и состава равновесного с ним пара при давлении Р. Укажите области на диаграмме, где в равновесии находятся жидкость и пар, только пар, только жидкость. Приведите примеры "точек" на этой диаграмме, для которых число степеней свободы равно а) 0, б) 1, в) 2.
3. Обоснуйте, в каких случаях можно использовать эксперименты по понижению температуры плавления раствора в зависимости от концентрации раствора для определения молекулярной массы растворенного вещества.
4. Температура замерзания чистого бензола T1 К,
а температура замерзания раствора, содержащего m1
г камфары в m2 г бензола, T2 К.
Энтальпия плавления бензола ![]() H кДж/моль. Определить молярную массу
камфары.
H кДж/моль. Определить молярную массу
камфары.
5. Для предотвращения замерзания водного раствора до температуры Тзам в 1 кг воды добавили 0.1 моль этиленгликоля. Показать, как изменится температура замерзания раствора, если в ту же массу воды добавить а) 0.05 моль этиленгликоля, б) 0.1 моль сахара, в) 0.1 моль хлорида натрия. Сделайте необходимые предположения о модели раствора.
6. Изобразите зависимость химического потенциала воды от температуры при Р = 1 атм вблизи температуры плавления. Как изменится вид этой зависимости, если в воду добавить хлорид натрия? Принять, что раствор идеальный и соль не растворяется в твердом растворителе.
7. Давление пара водного раствора, содержащего нелетучее растворенное вещество, на Р % ниже давления пара чистой воды. Определить моляльность раствора.
8. Давление пара над растворителем при температуре Т1 равно Р1. Когда в g1 г растворителя добавили g2 г маннита, то давление пара над раствором понизилось до Р2. Найдите молярную массу маннита, если молярная масса растворителя равна М1, а раствор идеальный. Чем определяется точность определения молярной массы этим методом?
9. Вещества А и В образуют идеальный раствор. Давление пара чистого А при 25 0С равно Р1 (мм рт. ст.). Давление пара чистого В равно нулю. Давление пара раствора, содержащего m1 г В и m2 г А, при 25 0С равно Р2 (мм рт. ст.). Найдите отношение молярной массы В к молярной массе А.
10. При 25 0С давление пара воды равно Р1 (Па). Вычислить давление пара над водой, содержащей x массовых долей (в процентах) глицерина.
11. Температура кипения бензола T1 К.
Его энтальпия испарения при температуре кипения ![]() H1 Дж/г.
Определить эбуллиоскопическую константу
бензола.
H1 Дж/г.
Определить эбуллиоскопическую константу
бензола.
12. Определить температуру кипения CCl4,
если в нем содержится w массовых долей (в %)
серы. Температура кипения чистого CCl4 T1 К,
энтальпия испарения ![]() H1 Дж/г.
H1 Дж/г.
13. В опыте g2 г твердого вещества были
растворены в g1 г растворителя, при этом
температура кипения увеличилась от Т1 до Т2.
Найдите молярную массу растворенного вещества,
если молярная масса растворителя - М1, а
энтальпия испарения ![]() H
кДж/моль при Т1. При каких условиях этот
метод можно использовать для определения
молярной массы веществ?
H
кДж/моль при Т1. При каких условиях этот
метод можно использовать для определения
молярной массы веществ?
14. Как с помощью измерения осмотического давления водного раствора фермента можно определить его молярную массу.
15. Показать, что для идеальных растворов двух
летучих жидкостей А и В суммарное давление пара:
Р = РА + РВ = ![]() + xB(
+ xB(![]() -
- ![]() ), где
), где ![]() и
и ![]() - давления
пара над чистыми жидкостями, xB - мольная
доля вещества В.
- давления
пара над чистыми жидкостями, xB - мольная
доля вещества В.
16. Используя закон Рауля, докажите, что кривые температурной зависимости давления насыщенного пара над чистым растворителем и идеальным раствором не идут параллельно, а расходятся.
17. При образовании идеального раствора с
разными количествами летучего растворенного
вещества (пар - идеальный газ) измерено понижение
температуры плавления растворителя, в первом
случае оказавшееся равным ![]() Т1, а во втором
Т1, а во втором ![]() Т2. Оцените изменение энергии Гиббса
в гипотетическом процессе переноса 0.01 моля
растворенного вещества из первого раствора во
второй при некоторой температуре Т, где ТПЛ <
Т < ТКИП растворителя.
Т2. Оцените изменение энергии Гиббса
в гипотетическом процессе переноса 0.01 моля
растворенного вещества из первого раствора во
второй при некоторой температуре Т, где ТПЛ <
Т < ТКИП растворителя.
18. В некоторый растворитель добавлены летучее и нелетучее вещества до получения идеальных растворов с одинаковой концентрацией. Изобразите в координатах "давление" - "температура" зависимости давления насыщенного пара растворителя от температуры для этих случаев и объясните взаимное расположение кривых.
19. Покажите, что численное значение эбуллиоскопической постоянной Е растворителя меньше значения его криоскопической постоянной К.
20. Почему при одинаковой концентрации
растворенного нелетучего вещества понижение
температуры плавления растворителя оказывается
большим по сравнению с увеличением температуры
его кипения: ![]() ТПЛ
>
ТПЛ
> ![]() ТКИП ?
ТКИП ?
21. Движение (транспорт) воды по стволу деревьев от корней до вершины "обеспечивает" одно из коллигативных свойств растворов. Какое?
22. Запишите уравнение, связывающее концентрацию растворенного вещества в жидком идеальном растворе и осмотическое давление. Запишите уравнение, связывающее концентрацию газа в идеальном газообразном растворе и его парциальное давление. Можно ли на основании сходства этих уравнений сделать вывод о близости физических свойств жидких идеальных растворов и смесей идеальных газов?
23. Две мембраны проницаемы для воды и непроницаемы для сахара, но различаются по своему химическому составу и размеру пор. Может ли осмотическое давление зависеть от природы этих мембран?
24. Один из механизмов, который называется "активным транспортом", осуществляется только в живых системах. Оцените величину работы, которая выполняется на биологической мембране при перенесении n молей вещества А из разбавленного раствора с концентрацией С1 в концентрированный раствор с концентрацией С2 (моль/л)? Сколько молей глюкозы нужно окислить для совершения этой работы?
25. Объясните, почему для растений, хорошо переносящих холод или устойчивых к засухе, характерна высокая концентрация веществ, растворенных в клеточном соке.
26. В толуол добавили g г полимера природного
происхождения и образовалось V л раствора,
плотность которого равна ![]() г/см3. Для измерения
осмотического давления этого раствора был
использован осмометр с полупроницаемой
мембраной. Высота столбика раствора,
обусловленная потоком растворителя через
мембрану, составила h см. Найдите молярную массу
полимера.
г/см3. Для измерения
осмотического давления этого раствора был
использован осмометр с полупроницаемой
мембраной. Высота столбика раствора,
обусловленная потоком растворителя через
мембрану, составила h см. Найдите молярную массу
полимера.
27. Сопоставьте чувствительность методов определения концентрации раствора белка в воде, основанных на измерении коллигативных свойств растворов.
28. Для определения молярной массы
поливинилпирролидона, основы кровезаменителя,
при 200С измерили осмотическое давление
раствора, содержащего 1 г
поливинилпирролидона в 100 г воды, которое
оказалось равным 20 мм рт. ст. Можно ли с
помощью метода криоскопии оценить молярную
массу этого полимера, если использовать такой же
раствор, а точность термометра ![]() 0.1 К?
0.1 К?
29. Запишите уравнение для фазового равновесия на границе мембраны, проницаемой для воды, по одну сторону которой находится водный раствор сахара с концентрацией М1 (моль/л), а по другую раствор сахара с концентрацией М2 (моль/л).
30. Получите выражение для изменения энтропии
и энергии Гиббса при образовании 1 моля
идеального бинарного раствора в зависимости от
его состава. При каких значениях мольных долей
компонентов эти зависимости имеют экстремумы и
чему равны величины ![]() mixS
и
mixS
и ![]() mixG в точках
экстремумов при заданной температуре Т?
mixG в точках
экстремумов при заданной температуре Т?
31. Изобразите зависимости функций смешения ![]() Н,
Н, ![]() S,
S, ![]() G,
G, ![]() V от состава идеального бинарного
жидкого раствора при температуре Т1. Как
изменится вид этих зависимостей, если
температуру опыта увеличить?
V от состава идеального бинарного
жидкого раствора при температуре Т1. Как
изменится вид этих зависимостей, если
температуру опыта увеличить?
32. Изобразите зависимости функций смешения ![]() Н,
Н, ![]() S,
S, ![]() G,
G, ![]() V от состава газового раствора,
компонентами которого являются азот и кислород,
при температуре Т1. Как изменится вид этих
зависимостей, если температуру опыта уменьшить?
Укажите выбранную Вами модель.
V от состава газового раствора,
компонентами которого являются азот и кислород,
при температуре Т1. Как изменится вид этих
зависимостей, если температуру опыта уменьшить?
Укажите выбранную Вами модель.
33. В какой пропорции необходимо смешать Н2О и D2О при заданных Р и Т а) по мольным долям, б) по массе, чтобы достичь наибольшего изменения энтропии?
34. Обоснуйте, как можно использовать результаты эксперимента по измерению осмотического давления для определения активности.
35. Измерено общее давление Р в системе, содержащий жидкий раствор А- В при заданной мольной доле xB и насыщенный пар. Экспериментально измерена мольная доля компонента В в паре yB в данной системе. В отдельных экспериментах измерены давления насыщенного пара для чистых веществ А и В Р0,A и Р0,B. Покажите, как можно из этих данных определить активности компонентов А и В в растворе.
36. Запишите уравнение Гиббса-Дюгема в любой форме.
37. При растворении в g1 г растворителя g2 г нелетучего вещества, давление пара над раствором уменьшилось на 5% по сравнению с давлением пара чистого растворителя. Найдите активность (в мольных долях) и соответствующий коэффициент активности растворителя в растворе, если молярные массы растворителя и растворенного вещества равны М1 и М2. Можно ли на основании приведенных данных рассчитать коэффициент активности растворенного вещества?
38. Давление паров изопропилового спирта над его водным раствором, содержащем w масс.% спирта равно Р1, а паров воды - Р2. Найдите активности и коэффициенты активности обоих компонентов в симметричной системе сравнения. Нужны ли дополнительные справочные данные для решения этой задачи?
39. В бинарном жидком растворе давление над чистым вторым компонентом равно Р02. Известно, что в области малых концентраций этого вещества (при мольной доле х2 < 0.05) зависимость его давления от х2 описывается законом Генри с константой К2. Найдите отношение коэффициентов активности второго компонента в симметричной и несимметричной системах сравнения при х2 = 0.5. Изменится ли эта величина при изменении х2.
40. Для растворов этанол- вода при 200 С
получены следующие данные (![]() - массовая доля С2Н5ОН в %,
Р - парциальные давления паров компонентов
раствора в мм рт. ст.):
- массовая доля С2Н5ОН в %,
Р - парциальные давления паров компонентов
раствора в мм рт. ст.):
0 |
20 |
50 |
80 |
100 |
|
| Р (С2Н5ОН) | 0 |
12.6 |
23.5 |
31.2 |
43.6 |
| Р (Н2О) | 17.5 |
15.9 |
14.5 |
11.3 |
0 |
Рассчитать активности и коэффициенты
активности для каждого компонента при ![]() , равной 50%. Какую систему
сравнения Вы использовали?
, равной 50%. Какую систему
сравнения Вы использовали?
41. Как рассчитать константу равновесия реакции С2Н4 (г) +H2O (г) = С2Н5ОН (ж) при 200С из справочных данных? Используя результаты, полученные при решении предыдущей задачи, найдите давление С2Н4 при равновесии с раствором, содержащим равные массовые доли воды и этанола. Каким будет давление С2Н4, если принять, что раствор идеальный?
42. Дана зависимость давления пара вещества 1
от состава бинарного жидкого раствора при
постоянной температуре:
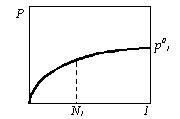
Покажите, как рассчитать коэффициент активности вещества 1 при концентрации N1 при двух различных способах стандартизации (в симметричной и несимметричной системах сравнения).
43. Показать, что если для бинарного раствора
ln![]() 2=kx12,
то ln
2=kx12,
то ln![]() 1=kx22,
где х1, х2,
1=kx22,
где х1, х2, ![]() 1,
1,
![]() 2 - мольные доли и
коэффициенты активности обоих компонентов
раствора соответственно, а k - постоянная.
2 - мольные доли и
коэффициенты активности обоих компонентов
раствора соответственно, а k - постоянная.
44. Химический потенциал компонента А в
неидеальном растворе А- В описывается уравнением
![]() А =
А = ![]() 0А + RT ln x2А,
где xA - мольная доля компонента А. Получите
выражение для химического потенциала компонента
В.
0А + RT ln x2А,
где xA - мольная доля компонента А. Получите
выражение для химического потенциала компонента
В.
Раздел 8. Растворы электролитов. Электродные процессы. Электродвижущие силы.
1. Как рассчитать константу диссоциации уксусной кислоты, используя таблицы стандартных термодинамических величин? Запишите выражение для константы диссоциации этой кислоты в реальном и идеальном растворе.
2. Известна зависимость энтальпии растворения серной кислоты в 1 кг воды от количества серной кислоты в растворе. Записать уравнение, согласно которому можно рассчитать парциальную мольную энтальпию растворения серной кислоты. Зависит ли эта величина от количества серной кислоты, добавленной в воду?
3. Оцените средний ионный коэффициент активности раствора СuСl2 по теории Дебая-Хюккеля при заданной моляльности раствора. Предложите способ определения этого коэффициента активности методом ЭДС.
4. Вычислить коэффициент активности водного раствора иодида рубидия с концентрацией 0.001 моль/кг при 298.15 К по 1-му приближению теории Дебая-Хюккеля и общую активность раствора.
5. Найдите общую активность водного раствора хлорида цезия с концентрацией 0.002 моль/кг при 298.15 К. Средний коэффициент активности рассчитать с использованием 1-го приближения теории Дебая-Хюккеля.
6. Найдите общую активность водного раствора нитрата натрия с концентрацией 0.003 моль/кг при 298.15 К. Средний коэффициент активности рассчитать с использованием 1-го приближения теории Дебая-Хюккеля.
7. Найдите общую активность водного раствора бромида калия с концентрацией 0.004 моль/кг при 298.15 К. Средний коэффициент активности рассчитать по 1-му приближению теории Дебая-Хюккеля.
8. Ионная сила разбавленных водных растворов трех бинарных электролитов KCl, BaCl2 и FeCl3 равна I. Найдите моляльность данных водных растворов и средние коэффициенты активности по 1-му приближению теории Дебая-Хюккеля.
9. Осмотическое давление крови человека равно 7.7 атм при "нормальной" температуре. Рассчитать концентрацию изотонического (имеющего такое же осмотическое давление) раствора хлорида натрия.
10. В каком случае количество выработанной электрической энергии с помощью некоторой батарейки может превысить абсолютную величину изменения внутренней энергии в химической реакции, протекающей в батарейке?
11. Известны стандартные электродные потенциалы для следующих процессов :
1) Cu2+ + e ![]() Cu+ Е01 = 0.153 В
Cu+ Е01 = 0.153 В
2) Cu+ + e ![]() Cu Е02 = 0.521 В
Cu Е02 = 0.521 В
Рассчитать Е03 для процесса Cu2+ + 2e![]() Cu.
Cu.
12. Известны стандартные электродные потенциалы для следующих процессов :
1) Hg2+ + 2e ![]() Hg Е01 = 0.854 В
Hg Е01 = 0.854 В
2) Hg22+ + 2e ![]() 2Hg Е02 = 0.798 В
2Hg Е02 = 0.798 В
Рассчитать Е03 для процесса Hg2+ + e![]() 0.5 Hg22+ .
0.5 Hg22+ .
13. Известны стандартные электродные потенциалы в водных растворах при 25 0С: Е0 (Cu+2/ Cu) = + 0.337 В, Е0 (Cl-/ Hg2Cl2, Hg) = 0.268 В.
Напишите окислительно-восстановительные процессы, протекающие на электродах, а также уравнение Нернста для расчета ЭДС обратимого гальванического элемента, составленного из этих электродов.
14. Записать схему электрохимической цепи, составленной из медного и цинкового электродов. Запишите уравнение Нернста для этой цепи. Объясните, при каких условиях может происходить окисление меди и восстановление цинка.
(Е0 (Zn+2/ Zn) = - 0.763 В, Е0 (Cu+2/ Cu) = 0.337 В).
15. Для электрохимической цепи:
Cu | Zn| ZnSO4 (р-р) | | CuSO4 (р-р) | Cu написать реакции на
электродах, реакцию в электрохимической цепи.
Показать, как, используя стандартные электродные
потенциалы, рассчитать ![]() rG реакции при 298 K, если активности
ионов равны а (Zn+2) и а (Cu+2).
rG реакции при 298 K, если активности
ионов равны а (Zn+2) и а (Cu+2).
(Е0 (Zn+2/ Zn) = - 0.763 В, Е0 (Cu+2/ Cu) = 0.337 В).
16. Для электрохимической цепи:
Cu | Zn | ZnSO4 (р-р) | | CuSO4 (р-р) | Cu написать реакции на
электродах, реакцию в электрохимической цепи. Показать, как, используя стандартные электродные потенциалы, рассчитать константу равновесия реакции при 298 K. В каком направлении пойдет химическая реакция при 298 К, если активности ионов равны 1?
17. Известны стандартные электродные потенциалы в водных растворах при 25 0С: Е0 (Cd+2/ Cd) = - 0.403 В, Е0 (Hg+2/ Hg) = 0.769 В.
Напишите окислительно-восстановительные процессы, протекающие на электродах, а также уравнение Нернста для расчета ЭДС обратимого гальванического элемента, составленного из этих электродов.
18. Известны стандартные электродные потенциалы в водных растворах при 25 0С: Е0 (Fe+2/ Fe) = - 0.440 В, Е0 (Cl- / AgCl, Ag) = 0.222 В.
Напишите окислительно-восстановительные процессы, протекающие на электродах, а также уравнение Нернста для расчета ЭДС обратимого гальванического элемента, составленного из этих электродов.
19. Известны стандартные электродные потенциалы в водных растворах при 25 0С: Е0 (Zn+2/ Zn) = - 0.763 В, Е0 (Cl-/ Hg2Cl2, Hg) = 0.268 В.
Напишите окислительно-восстановительные процессы, протекающие на электродах, а также уравнение Нернста для расчета ЭДС обратимого гальванического элемента, составленного из этих электродов.
20. Запишите схему электрохимической цепи, разность потенциалов на концах которой равна стандартному электродному потенциалу хлорсеребряного электрода.
21. Предложите способ определения стандартного электродного потенциала каломельного электрода.
22. Предложите гальванический элемент и
способ для определения стандартного
электродного потенциала ![]() при Т = 298 К, если известны значения
стандартной энтальпии образования иона Ni2+ (р-
р) и стандатных энтропий Ni (тв), Ni2+ (р- р)
и Н2 (г), а стандартные энтальпия
образования и энтропия Н+ (р- р) равны 0.
при Т = 298 К, если известны значения
стандартной энтальпии образования иона Ni2+ (р-
р) и стандатных энтропий Ni (тв), Ni2+ (р- р)
и Н2 (г), а стандартные энтальпия
образования и энтропия Н+ (р- р) равны 0.
23. Предложите гальванический элемент, составленный из электродов 1-го и 2-го рода. Напишите реакции, протекающие на электродах и уравнение Нернста для расчета его ЭДС.
24. Предложите гальванический элемент, составленный из стандартного водородного электрода и другого газового электрода. Напишите реакции на электродах и уравнение Нернста для расчета его ЭДС.
25. Предложите гальванический элемент, где протекает реакция
AgBr (тв) + 0.5Н2 (г) = Ag (тв) + НВr (водный р- р). Напишите реакции, протекающие на электродах. Как определить Е0 этого гальванического элемента?
26. Составьте гальванический элемент, в котором будет протекать химическая реакция: Hg2Cl2 (тв) + 2Ag (тв) = 2AgCl (тв) + 2Hg (ж). Предложите способ расчета стандартной ЭДС данного элемента при использовании таблицы стандартных термодинамических свойств.
27. Предложите гальванический элемент, в котором протекает реакция:
0.5Hg2Cl2 (тв) + 0.5Н2 (г) = Hg (ж) + HCl (водный р- р). Как определить средний ионный коэффициент активности в растворе HCl моляльности m из измерений ЭДС этого гальванического элемента?
28. Для электрохимической цепи: Pt | H2 |
HCl (р-р) | AgCl | Ag | Pt написать
реакции на электродах, реакцию в
электрохимической цепи. Показать, как, используя
стандартные электродные потенциалы, рассчитать ![]() rG реакции при
298 K, если средний ионный коэффициент
активности в растворе НCl с концентрацией m равен
rG реакции при
298 K, если средний ионный коэффициент
активности в растворе НCl с концентрацией m равен ![]()
![]() .
.
(Е0 (Cl- / AgCl, Ag) = 0.222 В).
29. В электрохимической цепи возможны
следующие реакции на электродах:
(1) О2 + 2Н2О + 4е = 4ОН-
(Е01 = 0.401 В) и
(2) AgCl +е = Ag + Cl- (Е02 = 0.222 В)
Запишите схему электрохимической цепи,
составленной из этих электродов. Запишите
уравнение Нернста для этой цепи. Рассчитайте, при
каком давлении кислорода может происходить
восстановительный процесс на хлорсеребряном
электроде.
30. Запишите схему электрохимической цепи, с помощью которой можно определить концентрацию кислорода в живых тканях. Запишите реакцию в электрохимической цепи и уравнение Нернста для этой цепи. Как с помощью термодинамических функций рассчитать стандартное значение ЭДС этой цепи?
31. Фермент алкогольдегидрогеназа (АДГ) катализирует окисление этилового спирта до ацетальдегида в соответствии с уравнением: С2Н5ОН + НАД+ + АДГ = СН3С(=О)Н + НАДН + Н+ + АДГ
Если этот процесс осуществить в электрохимической ячейке, то возможны следующие реакции на электродах:
(1) НАД+ + Н+ + 2е ![]() НАДН Е'0 (1) = -
0.32 В
НАДН Е'0 (1) = -
0.32 В
(2) СН3С(=О)Н + 2Н+ + 2е ![]() С2Н5ОН Е'0 (2) = -
0.20 В, где
С2Н5ОН Е'0 (2) = -
0.20 В, где
Е'0 (1) и Е'0 (2) - стандартные
электродные потенциалы при рН = 7 и 298 К.
1) Записать схему электрохимической цепи, в
которой может протекать данная реакция.
2) Написать уравнение Нернста для расчета ЭДС
этой цепи.
3) Рассчитать константу равновесия при рН = 7.
4) Рассчитать ![]() rG0 и
Е0 для этой цепи, если при выборе
стандартных состояний использована шкала
моляльных концентраций (1 моль/кг).
rG0 и
Е0 для этой цепи, если при выборе
стандартных состояний использована шкала
моляльных концентраций (1 моль/кг).
32. Напишите реакции, протекающие на электродах в гальваническом элементе, схема которого приведена ниже, а также суммарное уравнение процесса.
Pt | H2 |NaOH (водный р-р)| O2 | Pt
Принимая во внимание связь ЭДС с изменением энергии Гиббса, определите, как изменится его ЭДС с увеличением внешнего давления.
33. ЭДС элемента Вестона, в котором протекает
реакция: Cd (тв) + Hg2SO4 (тв) = CdSO4 (р-
р) + 2Hg (ж), при температуре T1 равна E1.
Предложите способ расчета ЭДС при другой
температуре T2, если известна энтальпия
реакции ![]() rH0,
которую можно считать постоянной в данном
интервале температур.
rH0,
которую можно считать постоянной в данном
интервале температур.
34. Для электрохимической цепи: Pt | H2 |
HCl (р-р) | AgCl | Ag | Pt показать,
как, используя стандартные электродные
потенциалы, рассчитать ![]() rG0 реакции при 298 K. Нужны ли
дополнительные справочные данные для расчета
константы равновесия,
rG0 реакции при 298 K. Нужны ли
дополнительные справочные данные для расчета
константы равновесия, ![]() rS0
и
rS0
и ![]() rН0 этой
реакции при 298 К?
rН0 этой
реакции при 298 К?
(Е0 (Cl- / AgCl, Ag) = 0.222 В).
35. Напишите реакции, протекающие на электродах в гальваническом элементе, схема которого приведена ниже, а также суммарное уравнение процесса.
Pt | H2 | HCl (водный р- р) | Cl2 (г) | Pt
Принимая во внимание связь ЭДС с изменением энергии Гиббса, определите, как изменится его ЭДС с увеличением внешнего давления.
36. Напишите реакции, протекающие на электродах в гальваническом элементе, схема которого приведена ниже, а также суммарное уравнение процесса.
Pt | H2 | HBr (водный р- р) | Br2 (г) | Pt
Принимая во внимание связь ЭДС с изменением энергии Гиббса, определите, как изменится ЭДС этого гальванического элемента с увеличением внешнего давления.
37. Напишите реакции, протекающие на электродах в гальваническом элементе, схема которого приведена ниже, а также суммарное уравнение процесса.
Pt | H2 | HCl (водный р- р) | Hg2Cl2 (тв) | Hg (ж) | Pt
Принимая во внимание связь ЭДС с изменением энергии Гиббса, определите, как изменится его ЭДС с увеличением внешнего давления.
38. При измерении рН раствора с использованием водородного электрода и стандартного каломельного полуэлемента (температура 298 К) давление барботируемого водорода оказалось несколько отличным от 1 атм. До какого значения можно изменить давление водорода, чтобы ошибка в определении рН не превысила 0.01?
39. Для определения рН некоторого раствора в горных условиях при 298 К применяется электрохимическая ячейка, включающая водородный электрод и каломельный полуэлемент. С ее помощью на равнине (Р (Н2) = 1 атм) установлено некоторое значение рН. Принимая во внимание, что давление водорода изменяется с высотой в соответствии с барометрической формулой: Р = Р0exp (- Mgh/RT), где M - молярная масса газа, h - высота, Р0 - давление газа на уровне h = 0, g - ускорение свободного падения, выведите формулу для расчета рН на произвольной высоте h.
40. В топливном элементе происходит окисление водорода кислородом. Как рассчитать разность потенциалов на концах этого элемента и максимальную электрическую работу, которую можно получить при окислении четырех грамм водорода при выбранных Вами условиях, если использовать таблицы стандартных термодинамических величин?
41. Вычислить произведение растворимости ВаСО3 при температуре 250С, если величины стандартных энергий Гиббса образования соединения в кристаллическом состоянии и соответствующих ионов в растворе равны (ккал/моль): - 272.2 (ВаСО3 (тв)), - 126.22 (СО32- ), - 134.0 (Ва2+).
42. Вычислить произведение растворимости каломели Hg2Cl2 при температуре 250С, если величины стандартных энергий Гиббса образования соединения в кристаллическом состоянии и соответствующих ионов в растворе равны (ккал/моль): - 50.35 (Hg2Cl2(тв)), - 31.35 (Cl- ), 36.35 (Hg22+).