Раздел 5. Применение термодинамики к фазовым равновесиям.
1. Изобразите диаграмму состояния углекислого газа. Покажите, как меняется число фаз, находящихся в равновесии, и число степеней свободы при изменении температуры одного моля СО2 от - 1000 С до 250 С при Р = 1 атм. Изменится ли ответ, если рассматривать систему из двух молей СО2?
2. Почему "сухой лед" (твердый углекислый газ) при обычных условиях испаряется, а "обычный" лед плавится?
3. Чему равно число степеней свободы в однокомпонентной системе, если число фаз, находящихся в равновесии, равно а) 1, б) 2, в) 3?
4. Запишите условия равновесия в системе лед - жидкая вода.
5. Может ли чистое вещество иметь четыре разных фазовых состояния? Если да, то могут ли все четыре фазы данного вещества находиться в равновесии при каких-либо условиях?
6. Изобразите зависимости химического потенциала и мольного объема воды от температуры вблизи температуры плавления при Р=1атм.
7. Изобразите зависимости химического потенциала и мольной энтропии воды от температуры вблизи нормальной температуры кипения.
8. Изобразите зависимости химического потенциала и мольного объема СО2 от температуры вблизи температуры плавления при р=10 атм.
9. Как меняется температура плавления льда и
температура кипения воды с уменьшением давления?
Затем выберите правильный вариант ответа: | ![]() Т (пл)| >|
Т (пл)| >| ![]() Т (кип)| , |
Т (кип)| , |![]() Т (пл)| = |
Т (пл)| = | ![]() Т (кип)| или |
Т (кип)| или |![]() Т (пл)| <
|
Т (пл)| <
|![]() Т (кип)| , где
Т (кип)| , где ![]() Т (пл) и
Т (пл) и ![]() Т (кип) - изменение температуры
плавления и температуры кипения соответственно.
Т (кип) - изменение температуры
плавления и температуры кипения соответственно.
10. Получите уравнение для зависимости температуры плавления чистого вещества B в зависимости от давления. Какие свойства вещества будут определять, увеличится или уменьшится температура плавления при увеличении давления?
11. Можно ли использовать уравнение
Клаузиуса-Клапейрона в форме dlnp/dT=![]() H/RT2 для расчета энтальпии
перехода между двумя кристаллическими
модификациями биологически активного вещества?
H/RT2 для расчета энтальпии
перехода между двумя кристаллическими
модификациями биологически активного вещества?
12. Как рассчитать, при каком давлении температура плавления льда понизится от 0 до -1 0С? Нужны ли для этого дополнительные справочные данные?
13. В температурном интервале 99- 1000 С при давлении, равном 1 атм, кипят вода и 2,2,4-триметилпентан. Для какого из этих веществ можно, не используя дополнительных данных, оценить давление насыщенных паров при комнатной температуре? Для какого из этих веществ давление паров при комнатной температуре будет выше?
14. Зависит ли давление пара над жидкостью, энтальпия и энтропия испарения от числа молей вещества?
15. Вам известны стандартные энтальпии
образования и энтропии двух кристаллических
модификаций вещества А' и A" при температуре T.
Предложите способ оценки давления, при котором
эти модификации вещества будет сосуществовать
при данной температуре. Плотности модификаций ![]() ' и
' и ![]() " соответственно.
" соответственно.
16. Как из справочных данных определить, при каком давлении пары йода будут находиться в равновесии с кристаллическим йодом при 25 0С. Что будет, если при этой температуре увеличить (уменьшить) внешнее давление?
17. Как из справочных данных определить, при каком давлении пары ртути будут находиться в равновесии с жидкой ртутью при 25 0С. Что будет, если при этой температуре увеличить (уменьшить) внешнее давление?
18. Как из справочных данных рассчитать давление насыщенного пара сульфурилхлорида SO2Cl2 при 25 0С. Что произойдет, если при этом давлении увеличить (уменьшить) температуру?
19. Как из справочных данных рассчитать давление насыщенного пара дисульфида углерода CS2 при 25 0С? Что произойдет, если при этом давлении увеличить (уменьшить) температуру?
20. Как из справочных данных определить, что устойчивее при 25 0С и 1 атм - ромбическая или моноклинная сера? При какой температуре при стандартном давлении ромбическая и моноклинная сера будут находиться в равновесии?
21. Как из справочных данных определить, что устойчивее при 25 0С и 1 атм - белый или красный фосфор? При каком давлении при этой температуре белый и красный фосфор будут находиться в равновесии?
22. Получено вещество, которое кипит при 25 0С, если давление равно 9 мм рт. ст. Как найти нормальную точку кипения? Нужны ли для этого дополнительные справочные данные?
23. Определить при какой температуре будет кипеть хлорбензол при давлении 2 мм рт. ст., если его н.т.к. 405.4 К, а при 4 мм рт. ст. он кипит при 383.2 К.
24. Давление пара метилового спирта при 293 К равно 94 мм рт. ст., а при 313 К - 259.4 мм рт. ст. Найти энтальпию испарения метанола и давление пара спирта при 333 К.
25. Зависимость давления насыщенного пара фреона ССl2F2 от температуры выражается уравнением : lgP (Па) = 34.5 - 2406.1/Т - 9.26 lgT + 0.0037 Т. Найдите энтальпию испарения 1 моля фреона при 298 К.
26. Зависимость давления насыщенного пара перфторорганического соединения, использующегося в качестве компонента искусственной крови, от температуры имеет вид: lg Р= а - b/Т - с lg T (Т, К; Р, Па), где а, b, с - постоянные. Найдите зависимость энтальпии и энтропии испарения этого соединения от температуры.
27. Найдите мольную энтальпию и энтропию сублимации белого фосфора при 298 К, если давление пара над твердым веществом выражено в виде lg Р (мм рт. ст.) = 9.6511 - 3296.9/T.
28. Зависимость давления пара Р над жидким
веществом Д от температуры Т (К) описывается
следующим уравнением:
lg Р = А - В/ Т. Как рассчитать ![]() U и
U и ![]() G в случае испарения двух молей вещества Д?
Какие допущения Вы использовали?
G в случае испарения двух молей вещества Д?
Какие допущения Вы использовали?
29. Стандартная энтальпия образования
твердого 1-аминоадамантана (С10Н15NН2),
который является основой противовирусного
препарата "Мидантан", равна ![]() fН0 при 298 К.
Зависимость давления насыщенного пара над
твердым соединением может быть выражена
уравнением:
fН0 при 298 К.
Зависимость давления насыщенного пара над
твердым соединением может быть выражена
уравнением:
lgP (атм) = A - B/T - ClgT (K). Как
рассчитать ![]() fН0
и
fН0
и ![]() fU0 при
298 К для газообразного 1-аминоадамантана?
fU0 при
298 К для газообразного 1-аминоадамантана?
30. Экспериментально определена зависимость давления насыщенного пара жидкого вещества А от температуры в виде ln Р = A + B/T + C ln T. Также экспериментально измерена энтальпия образования газофазной молекулы А. Предложите способ расчета энтальпии образования жидкого вещества А из данных двух экспериментов.
31. Энтальпия испарения воды при 373 К и давлении 1 атм равна 9710 кал/моль, а теплоемкости жидкой воды и пара равны 18.0 и 8.4 кал/моль? К соответственно. Как оценить энтальпию испарения воды при 383 К (Р2 > 1 атм)?
32. Зависимость давления насыщенного пара (идеальный газ) над некоторой жидкостью от температуры выражается уравнением:
ln Р (атм) = A - B/T - C ln T + DT (A, B, C, D - положительные
постоянные величины). Известна стандартная
мольная энтропия жидкости ![]() (ж) при температуре TХ < TН.Т.К..
Как, используя эти данные, можно рассчитать
стандартную мольную энтропию пара при
температуре TХ:
(ж) при температуре TХ < TН.Т.К..
Как, используя эти данные, можно рассчитать
стандартную мольную энтропию пара при
температуре TХ: ![]() (пар)
(пар)
(Р = 1 атм)?
33. Зависимость давления насыщенного пара (идеальный газ) над некоторой жидкостью от температуры выражается уравнением:
ln Р (атм) = A - B/T - C ln T + DT (A, B, C, D -
постоянные положительные величины). Как,
используя эти данные, можно рассчитать изменение
стандартного значения энергии Гиббса (![]() Р = 1 атм) при испарении
моля жидкости при температуре TХ < TН.Т.К..?
Почему в этом случае
Р = 1 атм) при испарении
моля жидкости при температуре TХ < TН.Т.К..?
Почему в этом случае ![]() ? 0, тогда как в случае испарения жидкости
при нормальной температуре кипения
? 0, тогда как в случае испарения жидкости
при нормальной температуре кипения ![]() G0 = 0?
G0 = 0?
34. Используя уравнение Клапейрона-Клаузиуса, покажите, что вблизи тройной точки однокомпонентной системы кривая температурной зависимости давления насыщенного пара над твердым веществом имеет больший наклон, чем аналогичная кривая для жидкости.
35. Зависимость давления пара от температуры
над твердым веществом может быть выражена в виде
ln P = a - b/T, а над жидким веществом
ln P = a* - b*/T (T, K; P, Па), где а, а*,
b, b* - постоянные. Найдите ![]() H затвердевания вещества в тройной точке.
H затвердевания вещества в тройной точке.
36. Зависимость давления пара от температуры над твердым веществом может быть выражена в виде lg Р = a - b/T, а над жидким веществом:
lg Р = a* - b*/T (T, K; P, Па), где а, b, а*,
b*- постоянные. Найдите ![]() S плавления вещества в тройной точке.
S плавления вещества в тройной точке.
Раздел 6. Химические равновесия.
1. В случае полного окисления глюкозы в
соответствии с уравнением: С6Н12О6 (тв.) + 6О2 = 6СО2 + 6Н2О (ж)
![]() rG0 = -
2862 кДж/моль при 298 К. Как рассчитать энергию
Гиббса этой реакции, если она протекает на
воздухе (парциальные давления О2 и СО2
принять равными 0.2 и 0.0003 атм соответственно)?
rG0 = -
2862 кДж/моль при 298 К. Как рассчитать энергию
Гиббса этой реакции, если она протекает на
воздухе (парциальные давления О2 и СО2
принять равными 0.2 и 0.0003 атм соответственно)?
2. Константа равновесия реакции Н2 (г) + J2 (г) = 2HJ (г) при температуре Т равна 50. Будет ли происходить образование HJ (г) при температуре Т и следующих начальных концентрациях реагентов С (моль/л), если газы считать идеальными?
| N | С (Н2) | С (J2) | С (HJ) |
| 1 | 0.5 | 0.25 | 5 |
| 2 | 1 | 2 | 10 |
3. Константа равновесия реакции Н2 + J2 (г) = 2HJ (г) при температуре Т равна 50. Как рассчитать стандартную энергию Гиббса этой реакции? Будет ли происходить образование HJ (г) при температуре Т и следующих начальных концентрациях реагентов С (моль/л), если газы считать идеальными:
| N | С (Н2) | С (J2 (г)) | С (HJ (г)) |
| 1 | 2 | 5 | 10 |
| 2 | 1 | 1 | 1 |
4. Давление диссоциации оксида двухвалентного переходного металла при температуре Т равно Р1 Па. Будет ли окисляться этот металл в кислороде, взятом при давлении Р2 = 10 Р1?
5. При смешении n0A молей кристаллов А и n0B молей газа В при равновесии образуется nC молей газа С по реакции А + 2В = 3С при общем давлении Р. Предложите способ расчета стандартной энергии Гиббса данной химической реакции. Какие дополнительные эксперименты необходимы для определения стандартной энтропии этой реакции?
6. При смешении n0A молей газа А и n0B молей газа В при равновесии образуется nC молей газа С по реакции 2А + 3В = 5С при общем давлении Р. Предложите способ расчета стандартной энергии Гиббса данной химической реакции. Какие дополнительные эксперименты необходимы для определения стандартной энтальпии этой реакции?
7. Когда при постоянных давлении и температуре по изменению энтальпии можно судить о направлении химической реакции?
8. В изолированной системе протекает химическая реакция. Изобразите качественно зависимость внутренней энергии и энтропии системы от химической переменной.
9. Определите КР газофазной реакции окисления аммиака при температуре Т=1000 К, протекающей по уравнению: NH3 + 0.75O2 = 0.5N2 + 1.5H2O, если константы равновесия реакций образования 1 моля NH3 (г) и Н2О (г) из простых веществ при той же температуре равны КР1 и КР2 соответственно.
10. Как рассчитать мольную долю PCl5 в
равновесной смеси при температуре Т (К) и общем
давлении 2 атм, если 2 моля PCl3 (газ)
смешаны с 1 молем Cl2 (газ), а константа
равновесия реакции: PCl3 (г) + Cl2 (г) = PCl5 (г)
равна 1 при той же температуре? Рассчитать ![]() rG0Т.
Газы считать идеальными.
rG0Т.
Газы считать идеальными.
11. Выведите соотношение между КP и КC для реакции А + В = С, где все участники реакции - идеальные газы. Приведите размерность КР и КС.
12. Определить КР и КС для реакции SO2Cl2 (г) = SO2 (г) + С12 (г) при 300 К и давлении 0.5 атм, если степень диссоциации SO2Cl2 равна 23.4%.
13. Найдите состав равновесной смеси, если при 718 К для газофазной реакции Н2 +I2 = 2 HI КР = 45.7. Исходные вещества взяты в эквивалентных количествах.
14. Константа равновесия реакции СО + Н2О = СО2 + Н2, которая протекает при 1089 К в газовой фазе, равна 1. Найдите состав равновесной смеси, получающейся из 2 молей СО и 3 молей Н2О. Газы считать идеальными.
15. Как вычислить ![]() U,
U, ![]() Н,
Н, ![]() F и константу равновесия для реакции С2Н2 + 2Н2 = С2Н6,
протекающей в газовой фазе при 500 К и давлениях
каждого газа, равных 2 атм, из справочных
данных? Записать выражение для константы
равновесия при выбранных Вами начальных
количествах реагентов. Газы считать идеальными.
F и константу равновесия для реакции С2Н2 + 2Н2 = С2Н6,
протекающей в газовой фазе при 500 К и давлениях
каждого газа, равных 2 атм, из справочных
данных? Записать выражение для константы
равновесия при выбранных Вами начальных
количествах реагентов. Газы считать идеальными.
16. Как вычислить ![]() Н
и
Н
и ![]() S для реакции:
С (графит) + 0.5О2 = СО при 1000 К
и давлениях каждого газа, равных 2 атм из
справочных данных. Записать выражение для
константы равновесия для этой реакции. Газы
считать идеальными.
S для реакции:
С (графит) + 0.5О2 = СО при 1000 К
и давлениях каждого газа, равных 2 атм из
справочных данных. Записать выражение для
константы равновесия для этой реакции. Газы
считать идеальными.
17. Как вычислить ![]() G и
константу равновесия для реакции:
С (графит) + СО2 = 2СО при 1000 К
и давлениях каждого газа, равных 5 атм из
справочных данных? Газы считать идеальными.
G и
константу равновесия для реакции:
С (графит) + СО2 = 2СО при 1000 К
и давлениях каждого газа, равных 5 атм из
справочных данных? Газы считать идеальными.
18. Как вычислить ![]() G и
константу равновесия для реакции:
СаО (тв) + CО2 = СaCО3 (тв.)
при 1000 К и давлении газа, равного 3 атм из
стандартных данных. Газ считать идеальным.
G и
константу равновесия для реакции:
СаО (тв) + CО2 = СaCО3 (тв.)
при 1000 К и давлении газа, равного 3 атм из
стандартных данных. Газ считать идеальным.
19. Равновесное давление паров кислорода над
Ag2O при Т (0С) равно
207 мм рт. ст. Как рассчитать ![]() fG0 Ag2O при этой
температуре? Записать уравнение, по которому
можно узнать, пойдет ли образование оксида
серебра на воздухе при той же температуре.
fG0 Ag2O при этой
температуре? Записать уравнение, по которому
можно узнать, пойдет ли образование оксида
серебра на воздухе при той же температуре.
20. При диссоциации NH4CI (тв) = NH3 (г) + НС1 (г) равновесное давление газов при 700.15 К равно 4560 мм рт. ст., а при 732.15 К - 8360 мм рт. ст. Найдите энтальпию этой реакции в предположении, что она не зависит от температуры.
21. Зависимость константы равновесия реакции СО+3Н2 = СН4+Н2О,
протекающей в газовой фазе, от температуры
имеет вид ln KР = - a + b/T. Стандартная
энтальпия сгорания метана при 298 К равна ![]() сН0 (CH4)
кДж/моль, а стандартные энтальпии образования Н2О
(г) и СО2 (г) равны
сН0 (CH4)
кДж/моль, а стандартные энтальпии образования Н2О
(г) и СО2 (г) равны ![]() fH0
(H2O) и
fH0
(H2O) и ![]() fH0
(CO2) кДж/моль. Стандартная энтальпия
испарения воды составляет
fH0
(CO2) кДж/моль. Стандартная энтальпия
испарения воды составляет ![]() VH0 кДж/моль. Найдите
стандартную энтальпию образования СО (г).
VH0 кДж/моль. Найдите
стандартную энтальпию образования СО (г).
22. Температурная зависимость константы равновесия реакции
Н2О (г) + СО (г) = Н2 (г) + СО2 (г) описывается следующим уравнением: lgKP = 2156/T - 2.2, а энтальпия сгорания СО при 298 К равна -283.0 кДж/моль. Найдите энтальпию образования Н2О (г) при 298 К.
23. Напишите выражение для константы равновесия КP приведенной реакции: CrCl2 (тв) + H2 (г) = Cr (тв) + 2 HCl (г),
обозначив через х число молей прореагировавшего Н2, а через Р общее равновесное давление. В начальный момент исходные вещества взяты в стехиометрическом отношении, а продукты отсутствуют. Все газообразные соединения - идеальные газы.
24. Напишите выражение для константы равновесия КP приведенной реакции:
(H2N)2CO (тв) + H2O (г) = 2 NH3 (г) + CO2 (г)
обозначив через х число молей образовавшегося СО2, а через Р общее равновесное давление. В начальный момент исходные вещества взяты в стехиометрическом отношении, а продукты отсутствуют. Все газообразные соединения - идеальные газы.
25. Напишите выражение для константы равновесия КР приведенной реакции: Fe3O4 (тв) + H2 (г) = 3 FeO (тв) + H2O (г), обозначив через х число молей образовавшегося водяного пара, а через Р общее равновесное давление. В начальный момент исходные вещества взяты в стехиометрическом отношении, а продукты отсутствуют. Все газообразные соединения - идеальные газы. Как изменится величина КP, если бы Fe3O4 и FeO образовали идеальный твердый раствор с мольной долей FeO 0.9?
26. Перечислите факторы, которые влияют на численное значение константы равновесия КР.
27. Зависит ли константа равновесия КР от концентрации реагирующих веществ? Аргументируйте свой ответ.
28. Обоснуйте температурную зависимость константы равновесия..
29. Для гипотетической химической реакции ![]() rН0 следующим
образом зависит от температуры:
rН0 следующим
образом зависит от температуры:
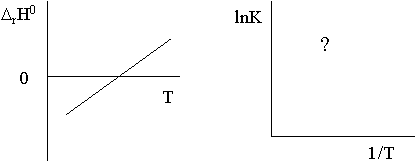
Изобразите зависимость константы равновесия для этой реакции от температуры в координатах ln К = f (1/Т).
30. В каком случае наблюдаются следующие
зависимости энтальпии реакции от температуры: а) ![]() rН0 = а, б)
rН0 = а, б) ![]() rН0= а+bТ, в)
rН0= а+bТ, в) ![]() rН0= а- bТ,
где а и b положительные постоянные величины?
rН0= а- bТ,
где а и b положительные постоянные величины?
31. Докажите, что степень диссоциации газа AB будет увеличиваться при увеличении температуры при постоянном давлении.
32. Степень диссоциации HBr не зависит от давления, но зависит от температуры. Объясните это.
33. Зависимость константы равновесия некоторой реакции от температуры можно выразить уравнением lnKР = - 6007/T + 5.407. Какая эта реакция - экзо- или эндотермическая?
34. Зависимость константы равновесия реакции
от температуры выражается в виде ln KР = a
- b/T, где а и b - постоянные. Зависят ли ![]() Н0,
Н0, ![]() S0,
S0,
![]() G0 и
G0 и ![]() С0Р этой реакции от
температуры?
С0Р этой реакции от
температуры?
35. Выразите константу равновесия КР реакции между идеальными газами А и В, взятыми в стехиометрическом отношении: А + В = С, обозначив через х число молей образовавшегося соединения С (газ), а через Р - равновесное давление.
36. Выразите константу равновесия КР реакции между идеальными газами А и В, взятыми в стехиометрическом отношении: 2А + В = С, обозначив через х число молей образовавшегося соединения С (газ), а через Р - равновесное давление.
37. Выразите константу равновесия КР реакции между идеальными газами А и В, взятыми в стехиометрическом отношении: А + В = 3С, обозначив через х число молей образовавшегося соединения С (газ), а через Р - равновесное давление.
38. Выразите константу равновесия КР реакции между идеальными газами А и В, взятыми в стехиометрическом отношении: А + В = 2С, обозначив через х число молей образовавшегося соединения С (газ), а через Р - равновесное давление.
39. Газовая реакция А = 2В протекает в закрытой системе до установления равновесия. Определите, как будет меняться выход продукта при увеличении общего давления в системе. Аргументируйте свой ответ.
40. Газовая реакция А + В = С протекает в закрытой системе до установления равновесия. Определите, как будет меняться выход продукта при увеличении общего давления в системе. Аргументируйте свой ответ.
41. Газовая реакция А + В = С + D протекает в закрытой системе до установления равновесия. Определите, как будет меняться выход продуктов при увеличении общего давления в системе. Аргументируйте свой ответ.
42. Газовая реакция А + 2В = С + D протекает в закрытой системе до установления равновесия. Определите, как будет меняться выход продуктов при увеличении общего давления в системе. Аргументируйте свой ответ.
43. Для реакции Н2О (г) + СО (г) = Н2 (г) + СО2 (г) температурная зависимость константы равновесия имеет вид lg KР = - a + b/T, где a и b - постоянные. Зависит ли энтальпия этой реакции от температуры? Как изменится выход продуктов при увеличении общего давления в системе? Газы считать идеальными.
44. В таблице приведены энтальпии образования (в кДж/моль) при 298 К для участников реакции: С6Н12О6 (тв) = 2С2Н5ОН (ж) + 2СО2 (г).
| С6Н12О6 (тв) | С2Н5ОН (ж) | СО2 (г) |
| - 1274.65 | - 276.98 | - 393.51 |
Как изменится константа равновесия этой реакции а) при увеличении температуры, б) при увеличении давления ? Ответ обосновать.
45. Стандартная энтальпия реакции: С2Н6 (г) = С2Н4 (г) + Н2 (г) при 298 К равна 32.79 кДж/моль. Как изменится выход этилена а) при увеличении температуры; б) при увеличении общего давления в системе. Ответ обоснуйте. Газы считать идеальными.
46. Стандартная энтальпия реакции гидрирования бензола при Т=298 К С6Н6 (г) + 3Н2 (г) = С6Н12 (г) равна 651.5 кДж/моль. Как объяснить, что промышленный синтез циклогексана проводят при высоких температуре и общем давлении в системе. Газы считать идеальными.
47. Стандартная энтальпия образования аммиака при Т = 298 К равна
- 46.2 кДж/моль. Как изменится выход аммиака а) при увеличении температуры; б) при увеличении общего давления в системе; в) при введении в систему подходящего катализатора? Газы считать идеальными.
48. Докажите, что степень диссоциации газа AB будет уменьшаться при увеличении давления при постоянной температуре.
49. Оценить, сколько максимальной полезной работы, необходимой для поддержания жизни, можно получить при полном окислении трех молей лактозы при 250 С в водном растворе.
50. Энергия Гиббса реакции АТФ4- + Н2О = АДФ3- + Н+ + НРО42-
при температуре Т и физиологическом значении рН
(= 7) равна - 30 кДж/моль. Как рассчитать ![]() rG0Т для
этой реакции, если в качестве стандартного
состояния выбрана единичная концентрация,
выраженная в моль/л? Запишите выражение для
константы равновесия этой реакции.
rG0Т для
этой реакции, если в качестве стандартного
состояния выбрана единичная концентрация,
выраженная в моль/л? Запишите выражение для
константы равновесия этой реакции.