|
Планирование многостадийных синтезов./ Органическая химия
Типы стратегий в ретросинтетическом
анализе
Начиная процедуру ретросинтетического
анализа, надо прежде всего ответить на следующие
вопросы:
1. Какие функциональные группы присутствуют в
ТМ?
2. Есть ли симметрия в ТМ? Симметрию лучше
сохранить в ходе анализа.
3. Есть ли аналогия в решении проблемы данного
синтеза с проблемами, уже решенными ранее?
4. Можно ли представить ТМ состоящей из
доступных или легко синтезируемых фрагментов?
Не существует универсального алгоритма, который
позволил бы, базируясь на структуре данной ТМ,
привести к однозначному нахождению исходных
соединений и пути синтеза ТМ. Это невозможно хотя
бы в силу множественности возможных решений
поставленной задачи (дерево синтеза).
Единственная возможность, реализуемая в
ретросинтетическом анализе - постепенное
уменьшение молекулярной сложности. Для
этого и существуют упрощающие трансформы. В ряде
случаев приходится использовать так называемые
"скрытые" пути упрощения структуры ТМ. Эти
"скрытые" пути могут включать использование
на каком-то этапе вспомогательного усложняющего
трансформа с тем, чтобы потом резко упростить
структуру.
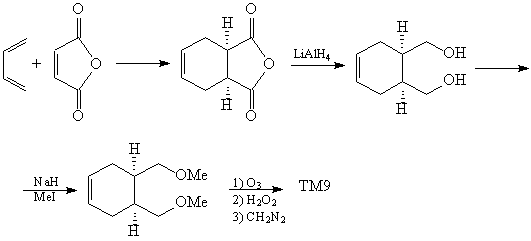
Рассмотрим пример ТМ9. В этом соединении легко
видеть два асимметричных атома углерода. ТМ9
представляется собой эритро-изомер (в данном
случае - мезо-форма).
Преобразовав проекцию Фишера в клиновидную
проекцию, мы увидим "вспомогательный ключ" -
определенное расположение выделенных атомов
водорода:
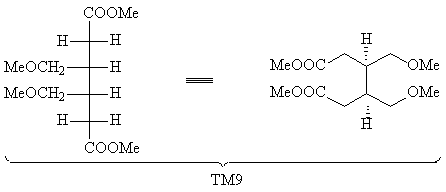
Использование в случае ТМ9 трансформа
гидрирования упрощает структуру, удаляя два
стереоцентра, однако дальнейшее расчленение
полученного алкена провести трудно:
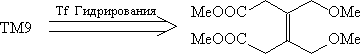
С другой стороны, мы можем на первых порах
усложнить ТМ6, проведя сочленение в шестичленный
цикл.
Анализ
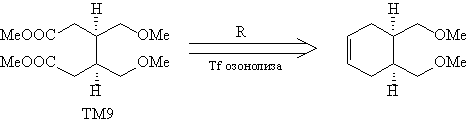
В соединении, полученном после трансформа
сочленение (R), присутствует полный ретрон
Дильса-Альдера. Однако, прежде чем прибегать к
его расчленению, следует видоизменить
функциональные группы (FGI), так как реакции
Дильса-Альдера благоприятствуют
электроноакцепторные группы в диенофиле.
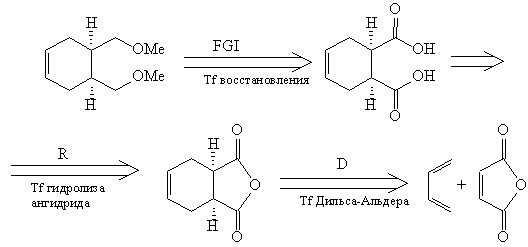
Теперь можно написать схему синтеза.
Синтез [32]
В ретросинтетическом анализе выделяют пять
основных стратегических линий, или стратегий [3,
33].
1.Стратегии, базирующиеся на трансформах.
Целью таких стратегий является поиск
наиболее мощного упрощающего трансформа,
который дает наибольший вклад в "дерево
синтеза". При этом приходится перебрать
несколько возможных первичных трансформов, то
есть поиск мощного трансформа становится самоцелью
(лучше сказать "подцелью"). При таком подходе
трансформы используются чисто механически, без
прямой связи с главной целью анализа -
нахождением способа синтеза данной ТМ.
Показателен в этом отношении анализ [34]
сесквитерпена - валеранона (ТМ7) - соединения,
обнаруженного в валериане
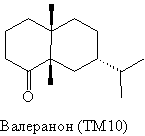
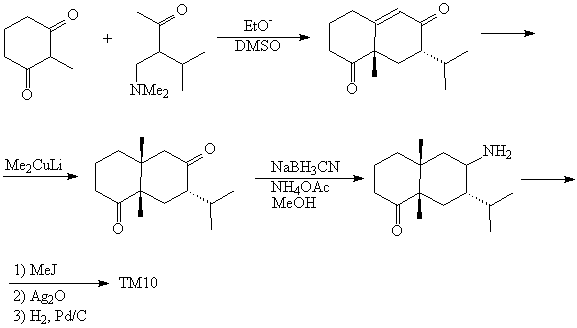
Анализ 1
Наличие в молекуле ТМ10 двух сочлененных
шестичленных колец, в одном из которых имеется
карбонильная группа, предполагает возможность
использования в анализе Tf Робинсона. Для
применения этого трансформа следует провести
дополнительный усложняющий трансформ (FGA) -
ввести еще одну карбонильную группу:
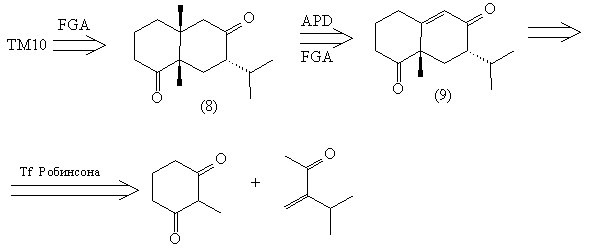
Мы пришли, таким образом, к двум легко
синтезируемым соединениям. Трансформам APD и FGA
соответствует присоединение
литий-диалкилкупрата:
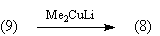
В плане синтеза трудность представляет
селективное удаление одной из карбонильных
групп в соединении (8). Эту проблему можно решить,
например, используя селективный восстановитель,
избирательно восстанавливающий менее
стерически затрудненную С=О-группу [35]:
Синтез
Анализ 2
Этот анализ тоже, по существу, базируется на
мощном упрощающем трансформе Робинсона, однако,
подход к нему иной.
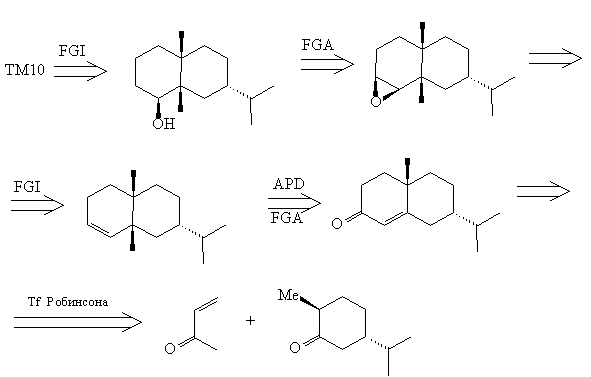
Синтез 2
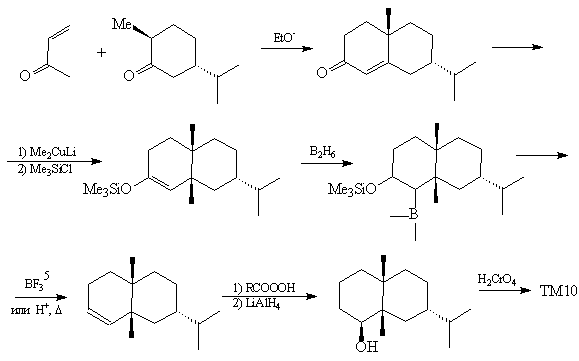 См. [36, 37] См. [36, 37]
Третий вариант анализа, также механически
базирующийся на трансформах, дает менее
удовлетворительные результаты.
Анализ 3
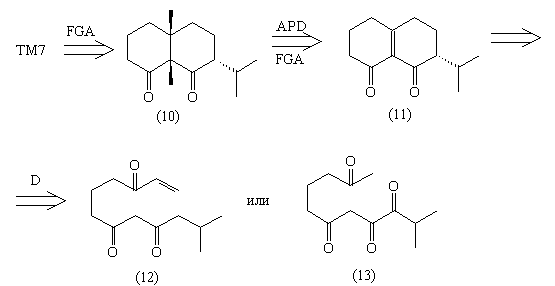
В последнем случае использованные чисто
механически трансформы привели к уменьшению
молекулярной сложности. Для превращения (11) в (10)
существуют вполне реальные реакции:
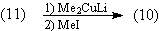
Что же касается продуктов дальнейших
расчленений - синтез соединений (12) и (13) сам по
себе представляет большие трудности.
Таким образом, стратегия, базирующаяся на
трансформах, представляет собой чисто
механический перебор всех возможных
трансформов. При этом вовсе не каждый путь
анализа приводит к удовлетворительному решению.
Следует отметить, что валеранон (ТМ10) был
синтезирован до того, как был проведен его
ретросинтетический анализ. Опубликованные
методы синтеза [38, 39] отличаются от тех, которые
предсказываются вышеприведенным анализом.
2.Стратегии, базирующиеся на структуре .
В этих стратегиях определяющая роль
принадлежит обнаружению в структуре ТМ
потенциального исходного соединения,
субъединицы, содержащей определенный ретрон или
начального хирального элемента для создания
правильных стереосоотношений в ТМ.
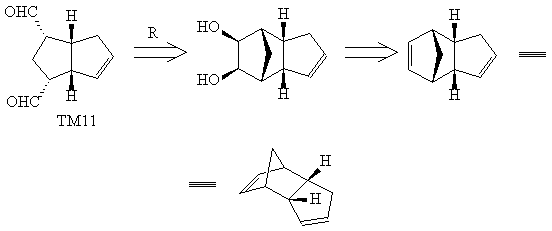
Так, в структуре ТМ11 - важного промежуточного
соединения для синтеза простагландинов, можно
увидеть родство с полициклической структурой
дициклопентадиена:
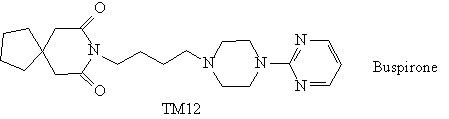
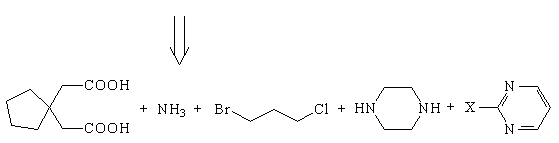
Исходные компоненты хорошо видны в структуре
успокаивающего лекарственного препарата ТМ12:
Гораздо труднее увидеть фрагмент исходного
соединения (14) для синтеза (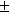 )-цедрола: )-цедрола:
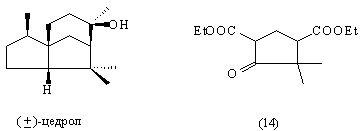
Соединение (14) было известно к началу работы Г.
Сторка по синтезу цедрола [40].
В ходе анализа некоторые связи и кольца
целесообразно сохранять, не подвергая их
расчленению. Такие фрагменты структуры обычно
берут начало из доступных соединений, так
называемых билдинг-блоков (building block, строительный
блок). Билдинг-блоком называется соединение,
содержащее одну или несколько функциональных
групп, позволяющих легко встраивать содержащий
структурный фрагмент в молекулы других
соединений. Сюда относятся, например, н-алкильные
группы, бензольные и нафталиновые кольца, а также
ряд гетероциклических структур. Билдинг-блок
может представлять собой и более сложное
образование (см. пример ТМ12).
3. Стратегии, основанные на топологии.
Эти стратегии предполагают обнаружение связи
(или связей), расположение которой, в
соответствии с ее положением в ТМ, дает
максимальное уменьшение молекулярной сложности.
Такие связи называются "стратегическими".
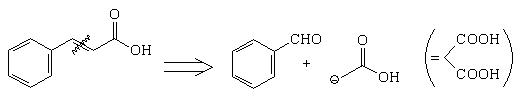
Ниже перечислены три основных типа
стратегических связей. Это:
а) связи, расположенные в середине молекулы;
б) связи, идущие из точки ветвления;
в) связи, непосредственно присоединенные к циклу.
Примеры:
а)
б)
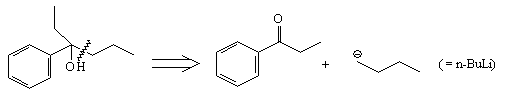
в)
Особенно важное значение имеет стратегия,
основанная на топологии, для расчленения при
анализе полициклических структур.
В циклических системах предпочтение надо
отдавать также расчленению стратегических
связей. Здесь уместно пояснить это понятие в
случае полициклических структур.
Прежде всего, следует напомнить два момента из
номенклатуры конденсированных и мостиковых
систем. В полициклах (15) и (16) пяти- и шестичленные
циклы называются первичными.

В то же время, циклы, образующиеся из (15) и (16)
путем разрыва связи (а) (в 15) или удаления
мостикового атома b (в 16), называются периферическими
циклами. Периферические циклы всегда
представляют собой циклы большего размера, чем
первичные циклы (в случае (15) получается 9-членный,
а в случае (16) - 7-членный циклы).
Стратегическими являются связи, составляющие
цикл, который является "конвертом" для двух
или более циклов меньшего размера. Так, в
приведенной ниже структуре стратегическими
являются выделенные связи, но не центральная
связь.
Связи, общие для двух циклов конденсированной
системы, не являются стратегическими.
Расчленение этих связей проводить нельзя.
Иными словами, нельзя проводить расчленение
конденсированной системы так, чтобы получался
цикл большего размера, чем первичные циклы.
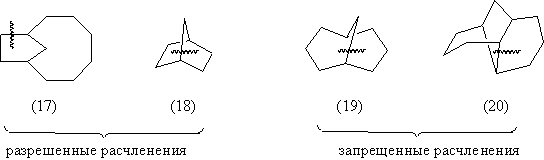
В случае мостиковых систем нельзя проводить
расчленение связи, общей для двух связанных
мостиком первичных циклов, если такое
расчленение приводит к циклу, содержащему более 7
атомов.
Так, расчленения, показанные в случае соединений
(17) и (18) допустимы, а расчленения, изображенные
для полициклических систем (19) и (20) - запрещены.
Если в конденсированной системе один из циклов
является трехчленным, то прежде всего следует
провести расчленение этого цикла. Данное правило
связано с тем, что не существует хороших способов
"пристройки" цикла большего размера к уже
существующему трехчленному циклу.
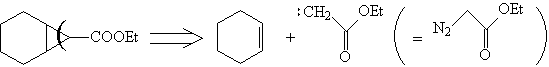
Не следует проводить расчленение
шестичленного ароматического кольца.
Ароматические соединения доступны, и создавать
бензольное кольцо нет нужды. Исключение
составляют легко ароматизируемые хиноны, но
необходимость в этом встречается редко.
4. Стратегии, основанные на стереохимии.
В данном случае речь идет о двух подходах:
создание определенной относительной
конфигурации (диастереоселективные стратегии) и
создание заданной абсолютной конфигурации
(хиронный подход).
Диастереоселективность может базироваться на
механизме реакции, соответствующей данному
трансформу.
Анализ
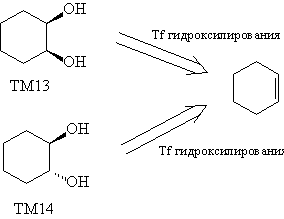
Проведенные трансформы уменьшили молекулярную
сложность ТМ13 и ТМ14, удалив стереоцентры. Однако,
это лишь половина решения, поскольку очень важно
найти синтетические реакции, которые
соответствуют данным трансформам и приводят к
нужному стереосоотношению частей молекулы. В
данном случае задача решается просто.
Синтез 1 [41]
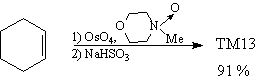
Синтез 2 [42]
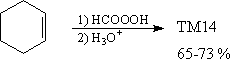
Другой пример иллюстрирует случай, когда
селективность создается пространственными
особенностями результата трансформа (т.е.
субстрата в плане синтеза).
Анализ
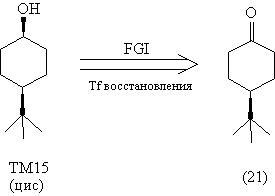
В данном случае при использовании селективного
восстановителя будет получаться именно
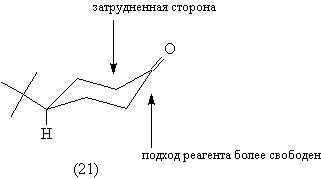
цис-изомер, поскольку в соединении (21) одна из
сторон шестичленного цикла пространственно
затруднена:
Синтез [43]
Таким образом, планирование синтеза соединений
с заданной стереохимией требует учета не только
самого трансформа (ретросинтетическое
направление), но и особенностей продукта
расчленения (субстрата) и реагента
(синтетическое направление). Задача облегчается
в тех случаях, когда в продукте расчленения
имеются внутримолекулярные предпосылки
протекания реакции с определенным
стереохимическим результатом. В качестве
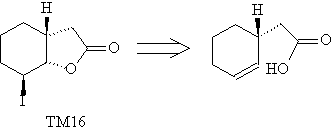
примеров можно привести трансформы
иодлактонизации (ТМ16) и внутримолекулярного
циклоприсоединения (ТМ17).
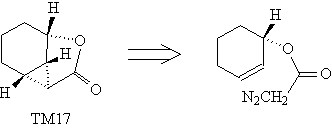
Другой подход, разработанный С. Ханессианом [44,
45] основан на хиральных синтонах, или хиронах.
Этот подход называется хиронным подходом,
или, более часто, подходом хиральных темплатов.
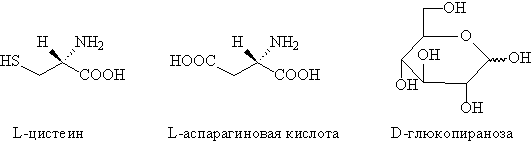
На схеме 1 (cхема заимствована из [45], 1990, iupac)
приводится сравнение синтонного и хиронного
подходов для анализа ТМ18:

Расчленение ТМ18 в соответствии с синтонным
подходом приводит к диену и карбену. В случае
хиронного подхода получается хирон, который
можно генерировать из подходящего хирального
темплата. Хиральными темплатами являются, как
правило, энантиомерно чистые природные
соединения, например:
По определению С. Ханессиана [46],
синтонный подход соотносится с "типом групп,
присутствующих в целевой молекуле, и с
химической осуществимостью реакций, либо
предшествующим опытом, которые диктуют
стратегию. Хиронный подход к синтезу включает
расчленение стратегических связей в целевой
молекуле, минимально затрагивающее стереогенные
центры. В идеале ищут максимальное сходство
функциональных групп, также как максимальную
близость стереосоотношений и углеродного
скелета между целевой молекулой (либо
какой-то подструктурой) и хироном. Именно тип
подструктуры и ее возможного хирального
предшественника диктуют стратегию и химию,
которые должны быть реализованы."
5. Стратегии, базирующиеся на функциональных
группах.
Функциональные группы часто входят в состав
того или иного ретрона и поэтому играют важную
роль при выборе трансформа и даже стратегии
анализа. В отличие от сложившейся традиции, в
ретросинтетическом анализе практически все
характерные группировки атомов, за исключением
алкильных (арильных) групп, считаются
функциональными группами.
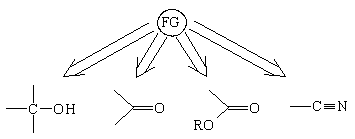
Помимо традиционных групп:
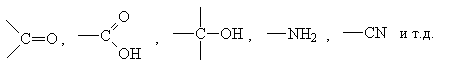
сюда следует отнести также следующие атомы и
группы атомов:
F, Cl, Br, I, -NO2, >C=C<, -C C- C-
и ряд других.
В простейшем случае расчленения можно
проводить на базе одной функциональной группы,
например:
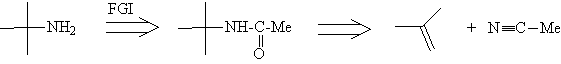
Очень важна способность одних функциональных
групп превращаться в другие (трансформ FGI), что
дает возможность регулировать реакционную
способность функциональных групп и, в то же
время, приводит к новым путям расчленения ТМ,
например:
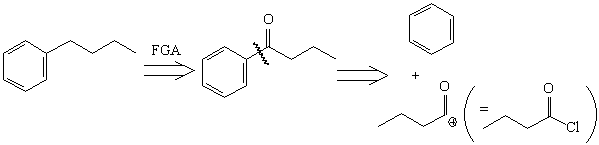
Анализ
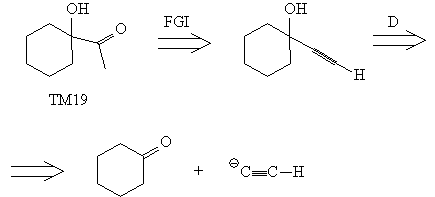
Синтез[47, 48]
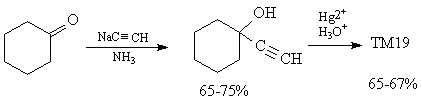
Расчленения на базе одной функциональной
группы высокоэффективны, если они:
1)разрывают стратегическую связь в кольце,
ответвлении или в цепи,
2) удаляют стереоцентр так, что его можно
стереоселективно создать из продукта
расчленения,
3) создают ретрон для нового упрощающего
трансформа,
4) дают возможность расчленения новой
стратегической связи.
Последнее положение иллюстрируется приведенным
выше анализом ТМ19.
Следует иметь в виду, что в ходе расчленения
могут возникнуть синтоны с обращенной
полярностью (Umpolung), либо другие, по каким-то
причинам "неудобные" синтоны или реагенты,
например (22)-(24).
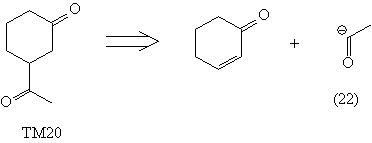
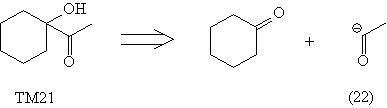
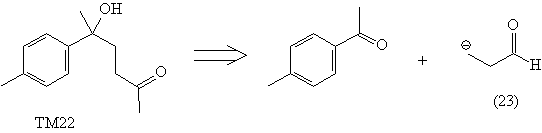
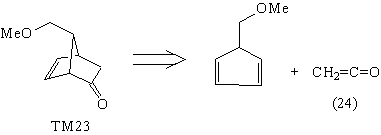
Недостатками проведенных анализов является
отсутствие реагентов (22) и (23), а также то, что
полученный в анализе кетен (24) является плохим
диенофилом и, кроме того, неудобен в обращении.
Разрешить эти трудности позволяет наличие синтетических
эквивалентов, содержащих латентные
(скрытые) функциональные группировки.
Синтетическим эквивалентом реагента
(функциональной группы) R называется
соединение Е, содержащее латентную
функциональную группу, эквивалентную в плане
реакционной способности функциональной группе
реагента R. Продукт реакции синтетического
эквивалента Е с субстратом S после простой
обработки дает тот же результат, который
получился бы в реакции реагента R с тем же
субстратом S.
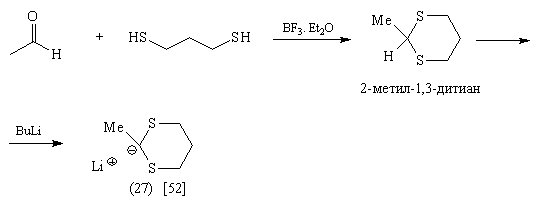
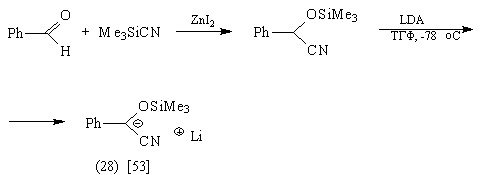
Так, синтетическими эквивалентами
ацетил-аниона являются соединения (25)-(28):
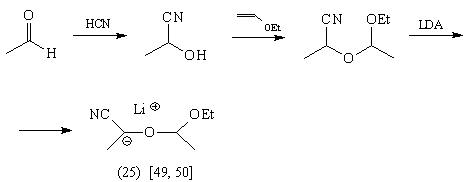
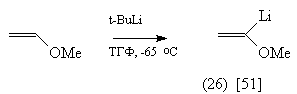
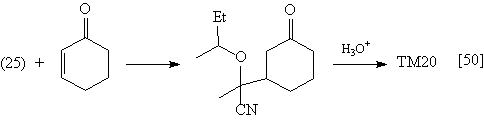
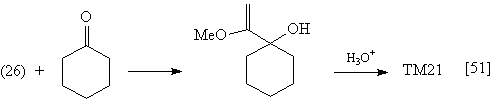
Реакции солей (25)-(28) с кетонами протекают
следующим образом:
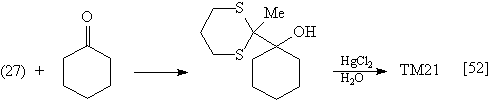
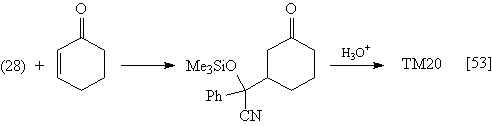
Предшественник синтетического эквивалента
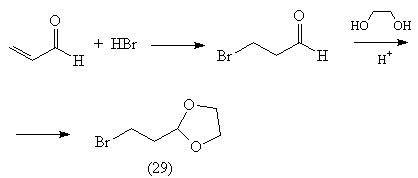
синтона (23), весьма полезный в синтезе реагент (29),
получают следующим способом [54]:
С помощью реагента (29) можно осуществить синтез
ТМ22:
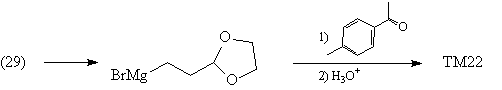
Удобным синтетическим эквивалентом кетена в
реакции Дильса-Альдера служит  -хлоракрилонитрил
[55]: -хлоракрилонитрил
[55]:
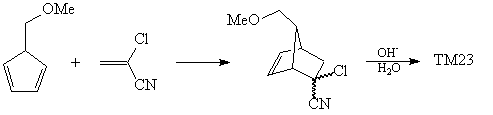
Дальнейшая методология анализа предполагает
правильный выбор трансформа. Следует помнить,
что трансформы должны соответствовать
известным реакциям.
При выборе трансформа полезны следующие
правила:
1. Вначале следует провести расчленение
связей, которые легко создаются. При этом лучше
всего удалить лабильные группы с тем, чтобы в
синтезе ввести эти группы в последнюю очередь.
Анализ
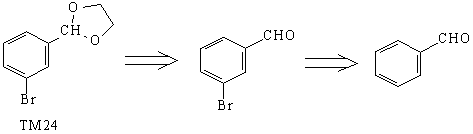
Если бы мы провели расчленение лабильной (и
легко создаваемой) ацетальной группировки в
начале анализа, она могла бы помешать
расчленению связи С-Br, поскольку в ходе
бромирования произойдет расщепление ацеталя.
Синтез
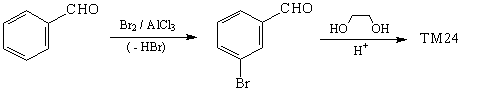
2. В том случае, когда в ТМ присутствует трудно
удаляемая (а, следовательно, и трудно вводимая)
группа, может быть, ее и не следует удалять. В
таком случае лучше попытаться найти доступное
исходное соединение, которое уже содержит нужную
группировку.
Как можно раньше следует удалить при анализе
группы, затрудняющие введение других групп
(например, группу NO2 в ароматических
соединениях).
3. Трансформ должен удалять как
можно больше функциональных групп и, если
возможно, стереоцентров.
4. Расчленение молекулы следует
проводить "малыми укусами" (small bites) на большие
осколки. Иными словами, надо добиваться
максимального упрощения структуры, разрывая
минимальное число связей. Этот принцип
является достаточно общим для
ретросинтетического анализа. Предпочтение
следует отдавать расчленению по стратегическим
связям (см. с.28 и след., "стратегии, основанные
на топологии").
5. Если необходимый Вам трансформ осложняется
наличием некой подструктуры, используйте
вспомогательный трансформ, удаляющий эту
подструктуру. Так, например, ТМ25 предполагает
проведение Tf эпоксидирования:
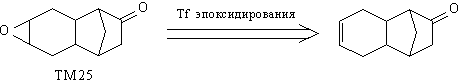
Однако, применять в данном случае Tf
эпоксидирования нельзя, так как при действии
надкислоты произойдет расширение цикла (реакция
Байера-Виллигера):
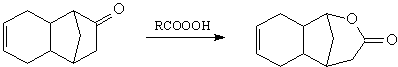
Поэтому для ТМ25 вначале надо применить
трансформ FGI (защита карбонильной группы):
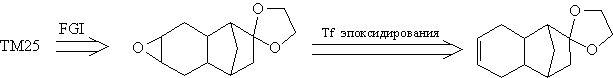
6. Существует лишь небольшое число реакций, в
которых одновременно образуются две или более
связей (например, реакция Дильса-Альдера
([4+2]-циклоприсоединение), реакции [2+1]-, [2+2]- и
[3+2]-циклоприсоединения). Поэтому предпочтение
следует отдавать таким трансформам, которые
соответствуют тандемным реакциям. В ходе
таких реакций возникающая связь сближает
определенные части молекулы, задействованные в
последующих превращениях. В качестве примера
можно привести аннелирование по Робинсону:
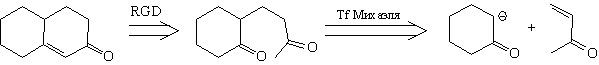
В данном случае реакция Михаэля сближает
карбонильную и метильную группы, что
благоприятствует альдольной конденсации,
приводящей к образованию шестичленного цикла
(аннелирование).
7. Предпочтение следует отдавать тем
трансформам, которые соответствуют "мощным
реакциям", например, реакции Дильса-Альдера,
альдольной конденсации и др. (см. табл. 1).
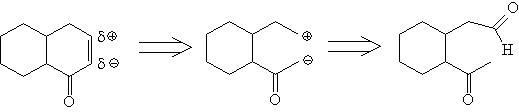
8. Предпочитайте расчленения ответвлений,
которые находятся рядом с такими
функциональными группами, как С=О и ОН. В этом
случае большую помощь может оказать анализ
естественной полярности связей, что быстро
приводит к нужным синтонам:
9. Рассмотрите все пары функциональных
групп в молекуле, чтобы найти трансформы для
наиболее продуктивных расчленений.
Последнее положение (9) вызвано тем, что
наиболее продуктивные расчленения получаются на
базе ретронов, включающих две функциональные
группы. Примем следующие обозначения ретронов (Х
и Y -функциональные группы):
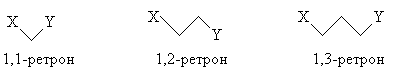 (тип I)
(тип I)
 (тип II)
(тип II)
Для ретронов типа (I) расчленение сводится, как
правило, к отщеплению группы Х (обычно в виде
анионного синтона). При этом отщепляющейся
группой Х может быть и углеводородный (алкильный,
арильный) фрагмент. Ретроны типа (II) предполагают
расчленение какой-либо из С-С связей, входящих в
состав ретрона, либо, наоборот, сочленение
(1,6-ретрон). Ретроны, в которых группы Х и Y
разделены более чем шестью атомами углерода, так
или иначе можно свести к ретронам типов I или II.
В плане синтеза наиболее продуктивны для
создания новых С-С связей соединения с
кислородными, а также нитрильной функциями.
Поэтому весьма полезной тактикой анализа
является превращение функциональных групп (FG) по
возможности в нитрильную, карбонильную или
сложноэфирную:
|


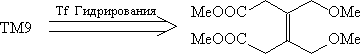





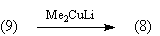


 См. [36, 37]
См. [36, 37]
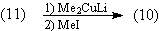



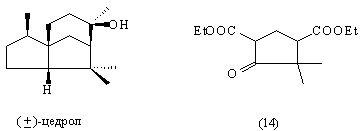






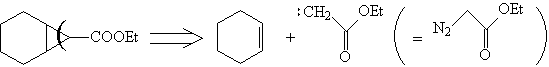

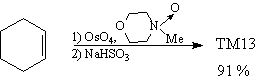
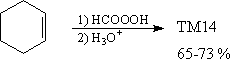


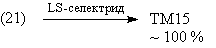

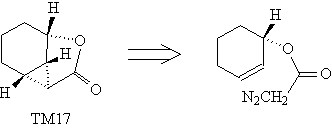



 C-
C-

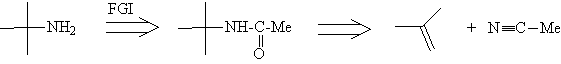







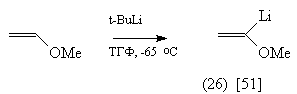







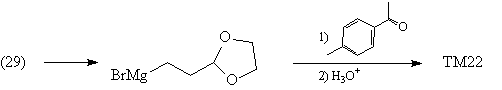



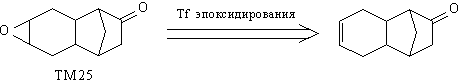
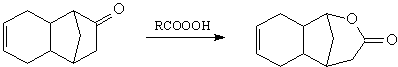

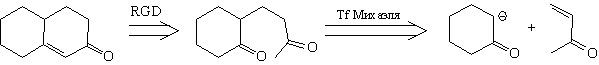

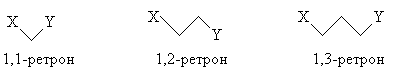 (тип I)
(тип I)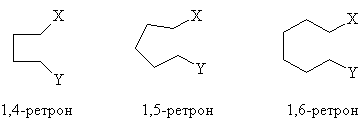 (тип II)
(тип II)