3.5. Формилирование ароматических соединений
Прямое введение формильной группы в бензольное кольцо впервые удалось осуществить Л.Гаттерману и Г.Коху в 1897 году. Формилирование по Гаттерману-Коху осуществляется под действием оксида углерода (II) и хлористого водорода в присутствии типичного катализатора Фриделя-Крафтса - хлорида алюминия, промотированного хлоридом меди (I).
![]()
Роль однохлористой меди в этой реакции неясна: возможно она связывает СО в комплекс, что способствует образованию крайне нестабильного хлористого формила HCOCl из CO и HCl, однако предположение об участии хлористого формила в реакции Гаттерман-Коха никогда не было строго доказано экспериментально. Таким путем удается ввести альдегидную группу в различные алкилбензолы, арилгалогениды, полициклические углеводороды и т.д., причем формильная группа вводится селективно в пара-положение. Высокие выходы альдегидов наблюдаются при использовании высоких давлений порядка 50-200 атм в отсутствии Cu2Cl2 или при обычном давлении в присутствии Cu2Cl2.
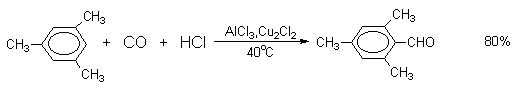
![]()
![]()
В лабораторных условиях необходимую для формилирования аренов смесь CO и HCl удобно получать при действии хлорсульфоновой кислоты на муравьиную кислоту.
![]()
В качестве формилирующего агента можно применять относительно стабильный газообразный фтористый формил при катализе трехфтрористым бором. Фтористый формил получается при взаимодействии смешанного ангидрида муравьиной и уксусной кислот с безводным фтористым водородом.
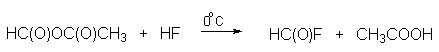
![]()
По существу реакцию Гаттермана-Коха можно рассматривать как частный случай ацилирования по Фриделю-Крафтсу, однако с гораздо более ограниченной областью применения. В ароматическое кольцо фенолов, нафтолов, их простых эфиров, аминов и N,N-диалкиланилинов с помощью CO и HCl ввести формильную группу не удается. Поэтому сам Гаттерман предложил другой метод введения альдегидной группы, в котором в качестве формилирующего агента использовалась смесь безводного HCN и газообразного хлористого водорода в присутствии кислоты Льюиса (реакция Гаттермана). Для того, чтобы избежать применения ядовитой синильной кислоты, Р.Адамс модифицировал условия реакции, заменив ее цианидом цинка. Это позволило из цианида цинка и HCl получать непосредственно в реакционной смеси HCN и безводный хлористый цинк, играющий роль слабой кислоты Льюиса. Этот метод дает хорошие результаты при формилировании фенолов и простых эфиров фенолов.
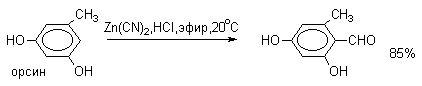
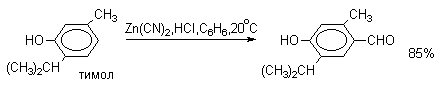
Истинная природа электрофильной частицы, принимающей участие при введении формильной группы с помощью HCN,HCl и кислоты Льюиса, точно не установлена, полагают, что ею может быть интермедиат типа HN=CHN=CHCl, однако каких-либо строгих доказательств этого не имеется. В настоящее время обе реакции Гаттермана в своем классическом варианте введения альдегидной группы в ароматическое кольцо редко применяются и представляют скорее чисто познавательный интерес.
Реакция Гаттермана стала очень популярной после того, как было установлено, что вместо цианидов для введения формильной группы можно использовать нетоксичный и легко доступный симметричный 1,3,5-триазин. Этот реагент обеспечивает высокие выходы альдегидов при формилировании алкилбензолов, фенолов, эфиров фенолов, конденсированных углеводородов и гетероциклических соединений.
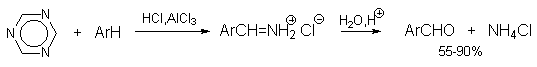
В синтетической практике для введения
формильной группы очень удобно использовать
легко доступные ![]() ,
, ![]() -дихлоралкиловые эфиры.
-дихлоралкиловые эфиры.
Это очень удобный лабораторный метод
формилирования конденсированных углеводородов,
бифенилов, фенолов и их простых эфиров. Главный
его недостаток состоит в низкой селективности
формилирования алкилбензолов для которых, как
правило, образуется смесь орто- и пара-изомерных
альдегидов примерно в равных количествах.
Необходимые ![]() ,
, ![]() -дихлоралкиловые
эфиры получаются при взаимодействии эфиров
муравьиной кислоты и пятихлористого фосфора.
-дихлоралкиловые
эфиры получаются при взаимодействии эфиров
муравьиной кислоты и пятихлористого фосфора.
![]()
Для введения альдегидной группы в ароматическое кольцо, активированное диалкиламино-, гидрокси- или алкоксигруппой, эффективна реакция, описанная в 1927 г А.Вильсмейером и А.Хааком. Диметилформамид (берется как реагент и растворитель) в присутствии хлорокиси фосфора является превосходным региоселективным формилирующим агентом. С помощью этого реагента альдегидная группа вводится в пара-положение по отношению к имеющимся NR2-; или OR-группам. Эту реакцию можно также рассматривать как ацилирование, где роль катализатора - кислоты Льюиса выполняет хлорокись фосфора (POCl3). Электрофильным агентом в реакции Вильсмейера-Хаака является иминиевая соль, которая образуется при взаимодействии ДМФА и хлорокиси фосфора (в чистом виде ее, как правило, не выделяют).
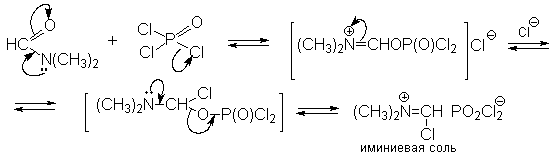
Иминиевая соль такого типа при необходимости может быть выделена в индивидуальном виде, например, при взаимодействии ДМФА с фосгеном, где после отщепления СО2 образуется соль (CH3N+ =CHCl) Cl- .
Реакция Вильсмейера-Хаака чрезвычайно проста в экспериментальном отношении и обеспечивает очень высокие выходы ароматических альдегидов, содержащих NR2-,OR- или OH-группы. Она оказывается практически ценной при формилировании конденсированных ароматических углеводородов - антрацена, азулена, пирена и др., а также разнообразных гетероциклических соединений ряда фурана, тиофена, пиррола, индола. В табл.4 приведены сводные данные по формилированию ароматических соединений с помощью различных реагентов, наглядно отражающие их достоинства и недостатки. В качестве субстратов выбраны алкилбензолы, фенолы, нафтолы, а также конденсированные углеводороды и бифенил.
Таблица 4
Формилирование ароматических
соединений с помощью
различных электрофильных агентов
Исходное соединение |
Реагент |
Катали-затор |
Условия реакции |
Продукт и выход % |
бензол |
CO,HCl |
AlCl3 |
150атм |
бензальдегид 85% |
бензол |
Cl2CHOCH3 |
TiCl4 |
CH2Cl2 |
бензальдегид 80% |
бензол |
|
AlCl3 |
20оС |
бензальдегид 30% |
толуол |
CO, HCl |
AlCl3, Cu2Cl2 |
50оС |
толуиловый альдегид 85% |
толуол |
|
AlCl3 |
20оС |
п-толуиловый альдегид 81% |
толуол |
HCN, HCl |
AlCl3 |
100оС |
п-толуиловый альдегид 90% |
мезитилен |
CO, HCl |
AlCl3, Cu2Cl2 |
40оC |
2,4,6-триметил-бензальдегид 80% |
мезитилен |
Cl2CHOCH3 |
TiCl4 |
CH2Cl2, 0оС |
2,4,6-триметил-бензальдегид 88% |
мезитилен |
HCN, HCl |
AlCl3 |
- |
2,4,6-триметилбенз-альдегид 13% |
мезитилен |
|
AlCl3 |
CH2Cl2 20оС |
2,4,6-триметил-бензальдегид 92% |
бифенил |
CO, HCl |
AlCl3, Cu2Cl2 |
бензол 40оC |
4-фенилбенз-альдегид 73% |
бифенил |
Cl2CHOCH3 |
SnCl4 |
CH2Cl2, 20оС |
4-фенилбенз-альдегид 80% |
бифенил |
|
AlCl3 |
CH2Cl2 20оС |
4-фенилбенз-альдегид 63% |
м-ксилол |
CO, HCl |
AlCl3, Cu2Cl2 |
40оC |
2,4-диметилбенз-альдегид 89% |
м-ксилол |
|
AlCl3 |
- |
2,4-диметилбенз-альдегид 46% |
нафталин |
HCOF |
BF3 |
CH2Cl2, -30оС |
1-нафтальдегид 73% |
нафталин |
Cl2CHOC4H9 |
TiCl4 |
CH2Cl2, 20оС |
1-нафтальдегид 79% |
нафталин |
|
AlCl3 |
хлор-бензол |
1-нафтальдегид 55% |
антрацен |
Cl2CHOC4H9 |
TiCl4 |
CH2Cl2, 0-20оС |
9-формил-антрацен 86% |
антрацен |
|
AlCl3 |
хлор-бензол |
9-формил-антрацен 55% |
антрацен |
ДМФА |
POCl3 |
ДМФА, 20оС |
9-формил-антрацен 84% |
фенантрен |
Cl2CHOC4H9 |
SnCl4 |
CH2Cl2, 20оС |
9-формил-фенантрен 92% |
фенантрен |
|
AlCl3 |
хлор-бензол |
9-формил-фенантрен 64% |
пирен |
Cl2CHOC4H9 |
TiCl4 |
CH2Cl2, 20оС |
1-формилпирен 88% |
фенол |
HCN, HCl |
AlCl3 |
бензол, 40оС |
4-гидроксибенз-альдегид, 30% |
фенол |
ДМФА |
POCl3 |
ДМФА, 20оС |
4-гидроксибенз-альдегид, 85% |
резорцин |
HCN, HCl |
ZnCl2 |
эфир, -5оС |
2,4-дигидрокси-бензальдегид, 70% |
резорцин |
CHCl2OCH3 |
SnCl4 |
CH2Cl2, 0оС |
2,4-дигидроксибенз-альдегид, 68% |
резорцин |
|
AlCl3 |
эфир, 20оС |
2,4-дигидроксибенз-альдегид, 77% |
2-нафтол |
CHCl2OCH3 |
SnCl4 |
CH2Cl2, 20оС |
2-гидрокси-1-формилнафталин, 82% |
2-метокси-нафталин |
ДМФА |
POCl3 |
ДМФА, 20оС |
2-метокси-1-нафтальдегид, 90% |
анизол |
Cl2CHOCH3 |
SnCl4 |
CH2Cl2, 0-20оС |
анисовый альдегид,73% |
анизол |
|
AlCl3 |
20оС |
анисовый альдегид, 67% |
анизол |
ДМФА |
POCl3 |
ДМФА |
анисовый альдегид, 21% |
анизол |
HCl |
Zn(CN)2 |
бензол, 40оС |
анисовый альдегид, 94% |
диметил-анилин |
ДМФА |
POCl3 |
ДМФА |
4-диметиламино-бензальдегид, 85% |
пиррол |
ДМФА |
POCl3 |
ДМФА |
2-пирролальдегид, 78% |
индол |
ДМФА |
POCl3 |
ДМФА |
3-индолальдегид, 97% |