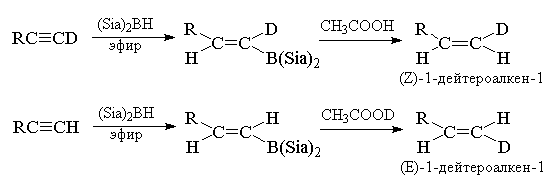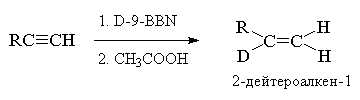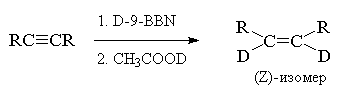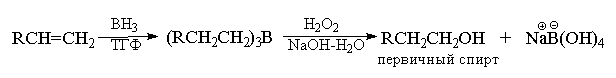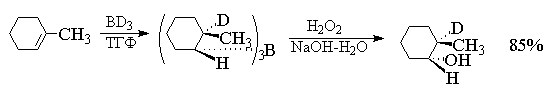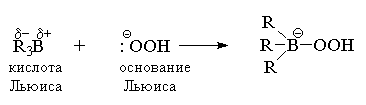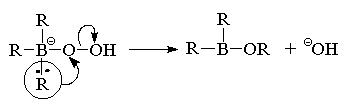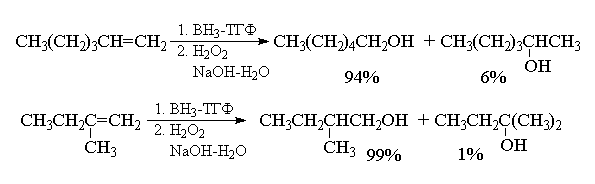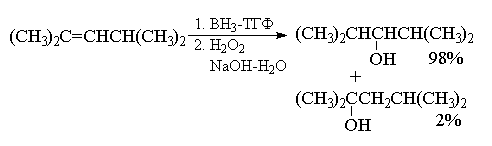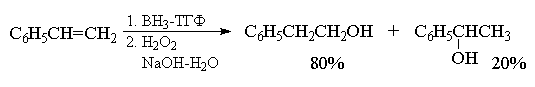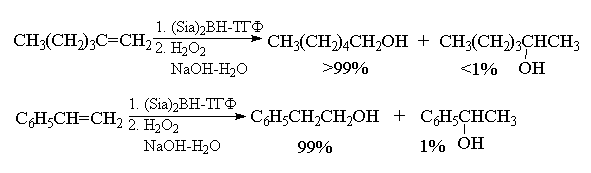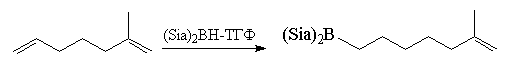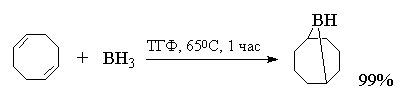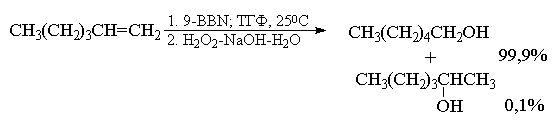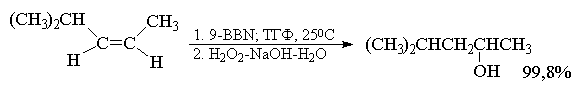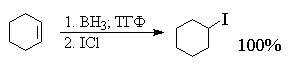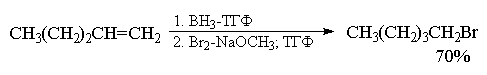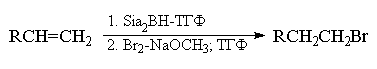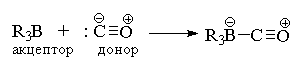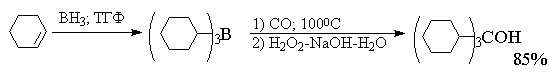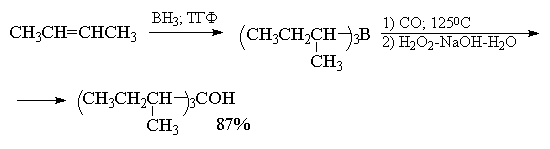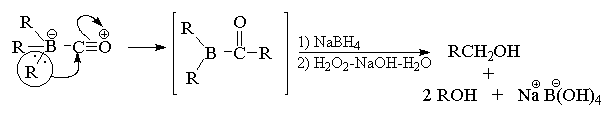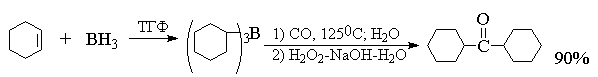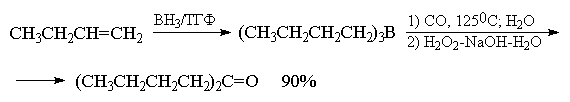|
4.6. Гидроборирование алкенов
Гидроборирование алкенов, открытое Г. Брауном в
1959 г., в настоящее время приобрело очень большое
значение в органическом синтезе, особенно в
многостадийных синтезах биологически активных
природных соединений. Гидроборирование алкенов
представляет собой присоединение гидридов бора
по двойной связи. Простейший гидрид бора, боран
ВН3, неизвестен. Это соединение является
крайне нестабильной кислотой Льюиса с секстетом
электронов у атома бора. Боран самопроизвольно
димеризуется в более стабильный диборан. Диборан
имеет необычную мостиковую структуру,
характерную для электронодефицитных молекул.
Мостиковая структура В2Н6 является
классическим примером двухэлектронной
трехцентровой связи В.. Н..В.
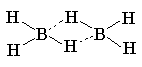
Четыре атома водорода и два атома бора диборана
лежат в одной плоскости, а оба "мостиковых"
атома водорода расположены над и под этой
плоскостью. Три атома В..Н..В связаны одной парой
электронов, поэтому такая связь называется
трехцентровой. Трехцентровая двухэлектронная
связь слабее обычной двухцентровой связи, но
зато в диборане таких связей две, что
обеспечивает определенную прочность димера.
Диборан представляет собой бесцветный, ядовитый
газ, мгновенно воспламеняющийся на воздухе,
поэтому все реакции с ним следует проводить в
инертной атмосфере. В настоящее время в
синтетической практике чаще используют не
диборан, а более стабильные и более селективные
гидроборирующие реагенты, такие как
дисиамилборан, тексилборан или
9-борабициклононан (см. стр.23, 29).
Диборан получают при взаимодействии
боргидрида натрия и эфирата трехфтористого бора
(Et2О. BF3) в тетрагидрофуране (ТГФ)
или диметиловом эфире этиленгликоля
(диметоксиэтане; ДМЭ).
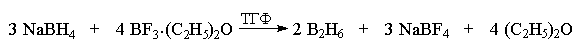
Если исходить из NaBD4, то этим способом
можно получить полностью дейтерированный
диборан В2D6. Диборан, как кислота
Льюиса, при взаимодействии с ТГФ или другим
простым эфиром, как основанием Льюиса, образует
донорно-акцепторный комплекс.
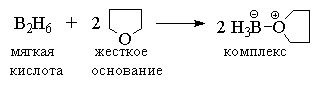
Этот нестабильный комплекс легко отщепляет BH3,
который быстро и количественно присоединяется к
двойной связи алкена с образованием
триалкилборана:
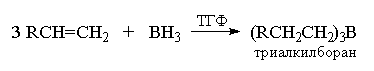
Гидроборирование в данном случае включает три
стадии. На первой стадии боран присоединяется к
алкену с образованием моноалкилборана.
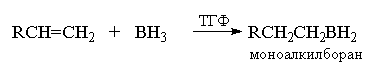
Моноалкилборан содержит две связи В-Н, поэтому
последовательно присоединяет еще две молекулы
алкена:
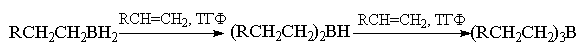
Присоединение борана к двойной связи
происходит региоселективно против правила
Марковникова таким образом, что атом бора
оказывается связанным с наименее замещенным
атомом углерода при двойной связи. Присоединение
борана по двойной связи происходит
стереоспецифично как син-присоединение с
одновременным связыванием атома бора и водорода
с двумя атомами углерода при двойной связи.
Поэтому обе новые связи С-В и С-Н образуется с
одной и той же стороны кратной связи. Для этой
реакции предложено четырехцентровое переходное
состояние
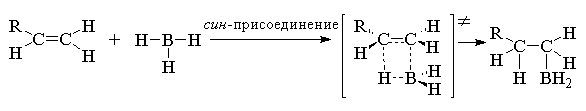
Региоселективность присоединения ВН3
легко предсказать на основании как электронных,
так и стерических факторов. Бор обладает меньшей
электроотрицательностью (2,0) по сравнению с
водородом (2,2), поэтому связь В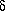 +
-Н +
-Н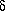 - должна быть слабополярной.
Кроме того, атом бора в боране является
электронодефицитным центром с пустой р-орбиталью,
что определяет его электрофильные свойства. - должна быть слабополярной.
Кроме того, атом бора в боране является
электронодефицитным центром с пустой р-орбиталью,
что определяет его электрофильные свойства.
Радиус атома бора больше радиуса атома
водорода, поэтому стерический фактор также
благоприятствует присоединению бора к наименее
замещенному и, следовательно, более
пространственно доступному атому углерода.
Полагают, что именно стерический фактор играет
решающую роль, и направление присоединения
борана к двойной связи определяется стерическим
контролем реакции.
Монозамещенные алкены в реакции с бораном
легко образуют триалкилбораны. В случае три- или
тетраалкилзамещенных при двойной связи алкенов
гидроборирование можно легко остановить на
стадии образования моно- или диалкилборанов,
содержащих разветвленные алкильные заместители.
Особенно большое значение в органическом
синтезе приобрел бис(1,2-диметилпропил)боран,
образующийся при взаимодействии ВН3 с
двумя молекулами триметилэтилена.
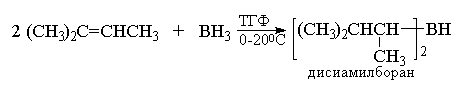
Этот реагент получил тривиальное
название дисиамилборан (Sia)2BH.
Тетраметилэтилен образует с бораном аддукт
состава (1:1), 1,1,2-триметилпропилборан, который
называется тексилбораном.
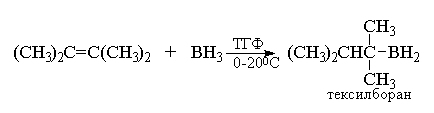
Син-присоединение борана к двойной связи
проще всего может быть проиллюстрировано на
примере гидроборирования 1-метилциклогексена с
помощью ВD3.
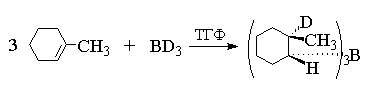
При этом образуется транс-трис(2-дейтеро-2-метилциклогексил)боран.
Алкилбораны, как правило, не выделяют в
индивидуальном виде, а используют
непосредственно для синтеза требуемого целевого
продукта. Алкилбораны являются ключевыми
реагентами для многих самых разнообразных
превращений (Г. Браун). Связь углерод-бор в
триалкилборанах легко расщепляется под
действием кислотных агентов с образованием
предельных углеводородов
(электроотрицательность бора 2,0; углерода 2,5):
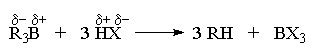
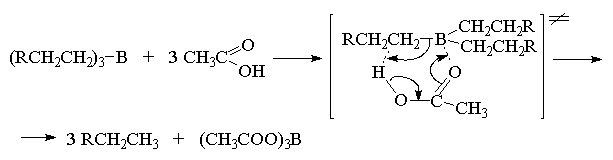
Так как карбоновые кислоты в этой реакции по
своей реакционной способности превосходят более
сильные кислоты -HC1, НВг и др., для протолиза
триалкилборанов был предложен механизм,
включающий шестизвенное циклическое переходное
состояние с нуклеофильной координацией
карбонильного кислорода по атому бора и
электрофильной атакой водорода
недиссоциированной формы RCOOH по атому углерода
триалкилборана.
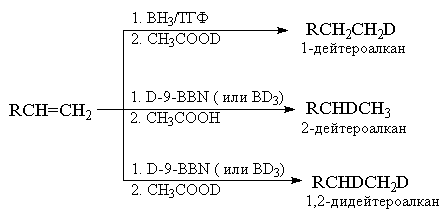
В целом гидроборирование алкенов с последующим
кислотным расщеплением триалкилборанов
представляет собой легко доступный и удобный
способ превращения алкенов в алканы. Этот метод в
сочетании с использованием дейтерированных
гидроборирующих агентов особенно удобен в том
случае, когда необходимо ввести изотопные
дейтериевые метки в алкан или циклоалкан. В
качестве кислотного агента используют также
дейтероуксусную кислоту СН3СООD.
Способ получения 9-BBN и его дейтероаналога
подробно рассмотрен на стр 27.
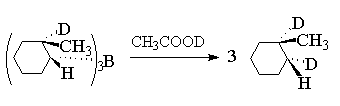
Последний пример показывает, что замена группы
-B(R)2 на дейтерий в этих условиях протекает
стереоспецифично с полным сохранением
геометрической конфигурации. Кроме того, этот
метод расщепления В-С-связи может быть с успехом
использован также для получения самых
разнообразных меченных алкенов, содержащих одну
или несколько дейтерированных меток у двойной
связи. При этом можно получать дейтерированные
алкены с определенной геометрической
конфигурацией. В качестве исходных соединений в
этом случае используют алкины (RC  CR, RC CR, RC  CH, RC CH, RC  CD), а в
качестве объемных гидроборирующих агентов (Sia2BH,
9-BBN или их дейтерированные аналоги, позволяющие
проводить селективное моногидроборирование
тройной связи. CD), а в
качестве объемных гидроборирующих агентов (Sia2BH,
9-BBN или их дейтерированные аналоги, позволяющие
проводить селективное моногидроборирование
тройной связи.
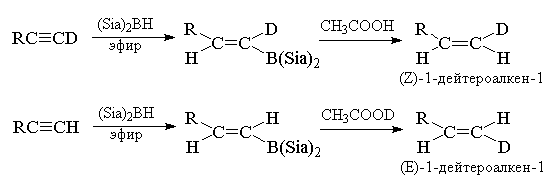
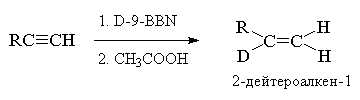
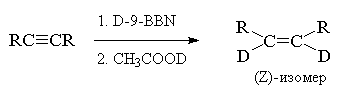
Более интересные и разнообразные
синтетические возможности открывает
расщепление триалкилборанов перекисью водорода
в щелочной среде. При обработке триалкилборанов
щелочным раствором пероксида водорода
происходит расщепление связи С-В с образованием
спиртов. Таким образом, последовательность этих
двух стадий гидроборирования алкенов,
представляет собой метод гидратации алкенов.
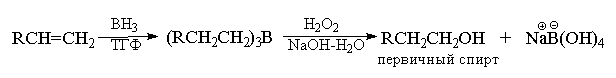
Гидроборирование несимметричных алкенов с
последующим окислением Н2О2
позволяет установить региоспецифичность и
стереоспецифичность всего процесса. Так,
например, при гидроборировании дейтеробораном
I-метилциклогексена с последующим окислением
триалкилборана щелочным раствором перекиси
водорода образуется транс-2-дeйтepo-2-метилциклогексанол.
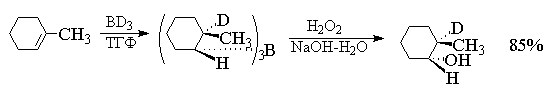
Это означает, что при окислении группа BR2
замещается на гидроксил с полным сохранением
геометрической конфигурации. Направление
гидратации алкена в этом двухстадийном процессе
полностью противоположно региоселективности
прямой гидратации алкенов или
региоселективности реакции
гидроксимеркурирования - демеркурирования
алкенов. Гидратация алкена, т.е. суммарный
процесс гидроборирования - окисления имеет
ориентацию прямо противоположную правилу
Марковникова (антимарковниковское
присоединение по кратной, связи). Для
ациклических монозамещенных и дизамещенных
алкенов гидроборирование - окисление дает
уникальную возможность синтеза первичных
спиртов с суммарным выходом 80-95%. Для
окислительного расщепления триалкилборанов в
щелочной среде предложен следующий механизм.
Сначала гидропероксид - ион присоединяется
к электронодефицитному атому бора
триалкилборана.
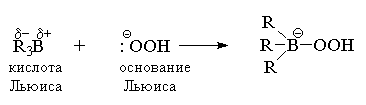
Образующийся при этом анионный боратный
интермедиат претерпевает перегруппировку с
потерей гидроксид - иона. Движущей силой
этой перегруппировки является образование очень
прочной связи В-0 вместо менее прочной связи С-В.
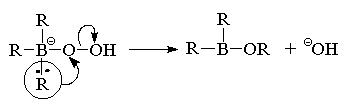
Более высокая прочность связи бора с
кислородом определяется дополнительным
перекрыванием заполненной 2р-орбитали кислорода
с пустой 2р-орбиталью бора, стабилизирующим связь
В-О. Первоначально образующийся продукт R2BOR
подвергается далее окислительному расщеплению
аналогично триалкилборану по описанной выше
схеме с образованием эфира борной кислоты
(триалкилбората).
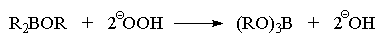
Триалкилборат в конечном итоге гидролизуется в
щелочной среде до спирта и борат-аниона.
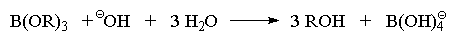
Региоселективность гидроборирования алкенов
под действием ВН3, определяемая совместным
действием электронных и стерических эффектов,
весьма высока и, как правило, превышает 90%. Ниже
приведены некоторые наиболее типичные примеры
гидроборирования - окисления алкенов.
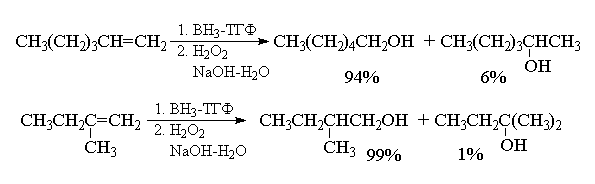
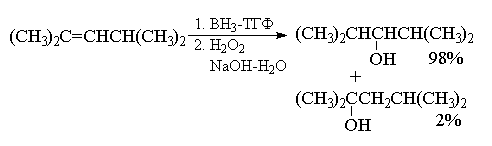
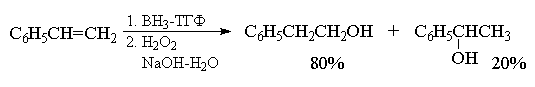
Селективность гидроборирования можно
значительно увеличить, если для
гидроборирования алкенов использовать
пространственно затрудненные диалкилбораны R2ВН,
например, дисиамилборан (Sia)2BH.
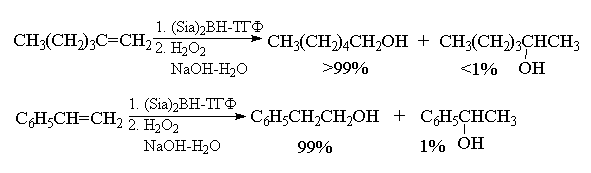
Другим; важным преимуществом пространственно
затрудненных дисиамилборана и тексилборана
является селективность гидроборирования
замещенных алкенов. Оба этих борана в 20-100 раз
более активны по отношению к незамещенной
концевой двойной связи, чем к 2-метилалкену-1. Это
позволяет селективно гидроборировать концевую
двойную связь в присутствии других двойных
связей:
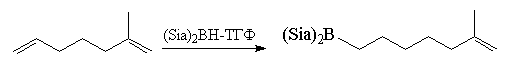
Тексилборан реагирует с цис-алкенами в 100
раз быстрее, чем с транс-изомерами, что широко
используется в тонком органическим синтезе.
В препаративных целях вместо дисиамилборана
можно использовать бициклический
9-борабицикло[3,З,1]нонан (9-BBN). Он не горюч, но
довольно легко окисляется на воздухе. Твердый 9-BBN
гораздо стабильнее алифатических боранов также
и термически. 9-Борабицикло[3,3,1]нонан получается
при присоединении ВН3 к легко доступному цис-цис-1,5~циклооктадиен.
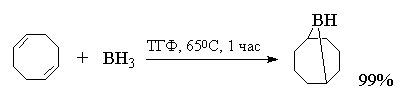
Его дейтерированный аналог D-9-BBN получают
восстановлением соответствующего хлорида с
помощью LiA1D4.
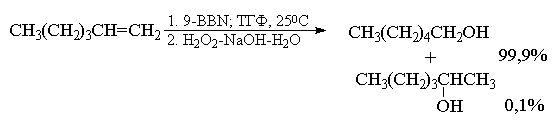
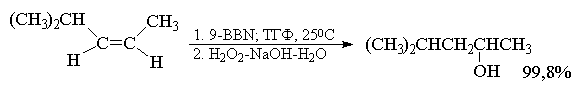
Триалкилбораны, образующиеся при
гидроборировании алкенов, можно использовать и
для синтеза алкилгалогенидов. Замена бора на иод
происходит при обработке триалкилборана иодом в
щелочной среде или хлористым иодом (ICl) в ТГФ. При
действии щелочного раствора иода отщепляются
только две из трех первичных алкильных групп
бороорганического соединения.
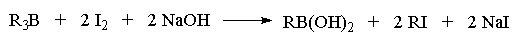
При иодировании триалкилборанов со вторичной
алкильной группой удается превратить во втор-RI
только одну из этих групп. Использование брома и
метилата натрия в ТГФ приводит к алкилбромидам с
хорошими, выходами.
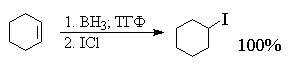
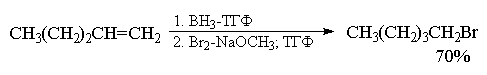
Региоселективность этих реакций также прямо
противоположна прямому присоединению
галогеноводорода к двойной связи. Алкены с
концевой двойной связью образуют первичные
алкилгалогениды.
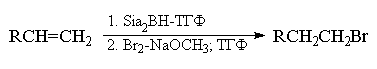
Применение триалкилборанов в органическом
синтезе получило дальнейшее развитие после того,
как была открыта реакция карбонилирования
борорганических соединений (Г. Браун,
М. Рашке, 1967 г.). Пустая р-орбиталь атома бора
в R3В перекрывается с заполненной
2s-орбиталью атома углерода монооксида углерода с
образованием аддукта состава 1:1.
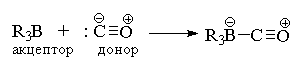
Этот аддукт не выделяют и сразу же используют
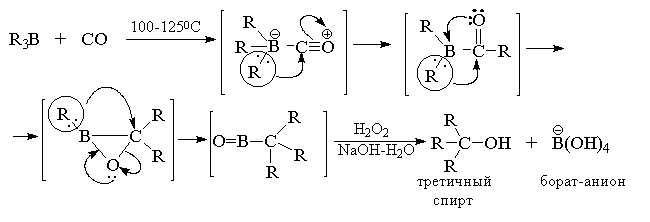
для дальнейших превращений. Характер продуктов
при этом определяется выбором условий реакции,
при которых происходит последовательная
миграция алкильных групп от бора к карбонильному
атому углерода аддукта. .Если триалкилборан
нагревают с монооксидом углерода при 100-120o
при атмосферном давлении, то происходит миграция
всех трех алкильных групп и после окисления
щелочным раствором перекиси водорода образуется
третичный спирт.
Эта реакций: представляет собой удобный метод
превращения алкена в третичный спирт с высоким
выходом.
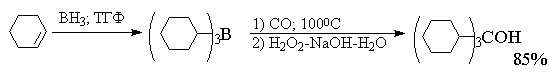
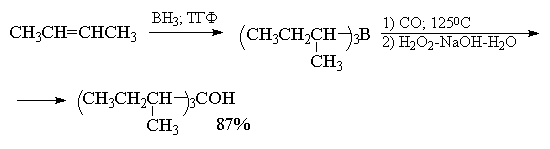
При наличии в реакционной смеси других
реагентов реакцию можно остановить на стадии
миграции одной или двух алкильных групп. Если
карбонилирование проводят в присутствии
боргидрида натрия, образуются первичные спирты.
Первичный, спирт получается в результате
восстановления под действием NaBH4
интермедиата, образующегося после миграции
только одной алкильной группы.
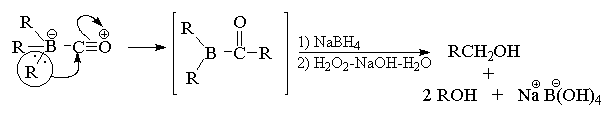
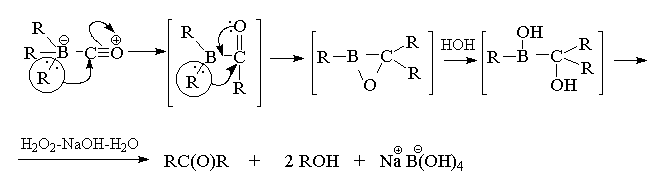
В присутствии эквимолярного количества воды
реакция останавливается на стадии миграции двух
алкильных групп. Последующее расщепление
борэпоксида щелочным раствором перекиси
водорода приводит к симметричному кетону с
высоким выходом.
В качестве типичных примеров приведем
получение дициклогексилкетона и нонанона-5.
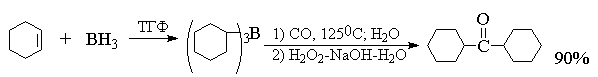
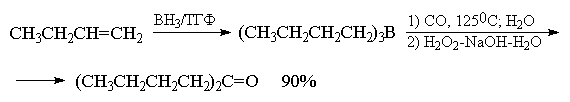
|


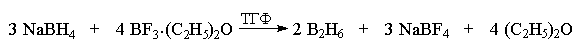
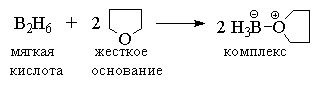
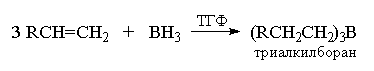
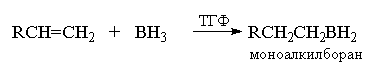
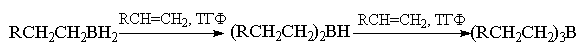

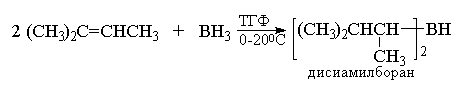
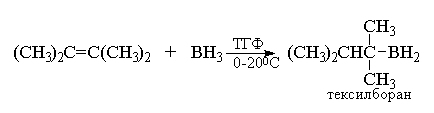
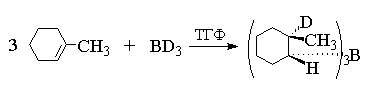
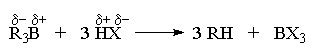



 CR, RC
CR, RC