В.В.Загорский
Трудные темы школьного курса химии
Строение атома и Периодический закон [ 1]
Урок 1
(За основу взяты лекции автора для студентов биофизиков и биоинженеров МГУ
[ ])
])
Общие методические рекомендации преподавателю
Уровень изложения соответствует образовательному стандарту по химии профильного уровня [ ].
].
Эта сложнейшая межпредметная тема, сочетающая философию, математику, физику и химию, многим преподавателям кажется простой. Но сведение непредставимых на уровне вещественно-механических представлений объектов квантового мира к вульгарным наукообразным моделям искажает картину и делает ее бессмысленной. А тех немногих студентов, которым предстоит профессионально заниматься квантовой механикой, приходится после изучения школярских « орбиталей » полностью переучивать. В последние годы увлечений «инновациями» забыты результаты исследований российских психологов [ 2]:
Специальные исследования Центрального научно-исследовательского института политехнического образования (1933 г) показали, что для учащихся в возрасте до 14 лет, привыкших мыслить конкретно, очень труден, а иногда и непосилен переход от конкретных явлений к абстрактным понятиям, от непосредственно видимого и ощущаемого к тем взаимодействиям, которые происходят между атомами и молекулами. Особенность химии состоит в том, что в ней самые основные понятия (смесь и индивидуальное вещество, атом и молекула, относительная атомная масса, валентность) являются одними из самых трудных для понимания, но без этих понятий невозможно построить систематический курс [ 2]. В результате программа была построена так, что в 7-м классе (14 лет) изучались отдельные факты (реакции), закон постоянства состава и основы атомно-молекулярного учения; в 8-м классе (15 лет) школьники проходили химию элементов (неметаллы) и растворы; и лишь в 9-м классе (16 лет) наряду с химией металлов изучался периодический закон и строение вещества. Для органической химии отводился 10-й класс. Подобное построение курса сохранялось примерно до середины 90-х годов.
В данной теме особенно важно соблюдать модельный ряд естественнонаучного знания [ ]:
]:
- Идеализированные образы (физические модели)
- Эмпирический материал (экспериментальные данные)
- Математическое описание (формулы и уравнения)
Наиболее типичные искажения в преподавании элементов квантовомеханических представлений – смешение физических моделей и их математического описания.
Дополнительные материалы по теме, в том числе самого высокого уровня сложности можно найти в энциклопедии «Физика в Интернете» [ ]
]
Ресурсы иллюстраций по физике: [  ]
]
Квантовая теория излучения
Впервые понятие "квант" (порция) применительно к излучению было сформулировано Максом Планком [  ] в 1900 г. для создания теории излучения света нагретыми твердыми телами. Для начала попробуем разобраться, с какой целью создавалась теория излучения и почему потребовалось делить излучение на порции.
] в 1900 г. для создания теории излучения света нагретыми твердыми телами. Для начала попробуем разобраться, с какой целью создавалась теория излучения и почему потребовалось делить излучение на порции.
Демонстрация:
Спираль обычной электрической лампы накаливания (на 220 В) может светиться разным цветом в зависимости от напряжения (В) – от красноватого при 700o С до белого при 2500oС. Если же изменять напряжение на электродах индикаторной неоновой лампы, то при напряжениях от 100 до 220 В розово-красный цвет излучения не меняется.
В чем же причина разной зависимости излучения ламп от напряжения?
Газоразрядные лампы, подобные использованной в эксперименте неоновой, были уже известны в конце 19 века. Несколько раньше в практику лабораторий вошли спектральные измерения [  (текст)
(текст)  (текст)] [
(текст)] [  (спектроскоп) ].
(спектроскоп) ].

Спектроскоп и спектры в видимой области (исследования конца XIX века)
Д.Менделъевъ. Основы химiи / 6-е издание, С-Пб, 1895, стр. 392-393


Некоторые газы светятся яркими цветами при пропускании через них электрического тока, – это явление широко используется сейчас для рекламных вывесок. При пропускании света, излучаемого газоразрядными лампами, через призму, он распадается на ряд узких цветных полос. Солнечный свет превращается после пропускания через призму в радугу – набор плавно переходящих друг в друга цветов.
Демонстрация:
Похожую радугу можно получить с помощью призмы и от лампы накаливания [ (раздел 3.10)]. Такую радугу первооткрыватель явления И.Ньютон (17 век) назвал " spectrum " – видение (лат.) [
(раздел 3.10)]. Такую радугу первооткрыватель явления И.Ньютон (17 век) назвал " spectrum " – видение (лат.) [ ] . Сейчас спектром принято называть любой график (или фотографию), на котором изображены длины волн и энергия излучения, соответствующая каждой волне. Цвета в радуге соответствуют определенным длинам световых волн . Человеческий глаз видит в диапазоне волн примерно от 400 нм до 800 нм (1 нм = 10-9 м). Коротковолновый предел соответствует фиолетовому цвету, длинноволновый – красному. Точные измерения показали, что и солнце, и спираль лампы накаливания излучают невидимый глазом свет – с длинами волн меньше 400 нм (ультрафиолетовый) и больше 800 нм (инфракрасный).
] . Сейчас спектром принято называть любой график (или фотографию), на котором изображены длины волн и энергия излучения, соответствующая каждой волне. Цвета в радуге соответствуют определенным длинам световых волн . Человеческий глаз видит в диапазоне волн примерно от 400 нм до 800 нм (1 нм = 10-9 м). Коротковолновый предел соответствует фиолетовому цвету, длинноволновый – красному. Точные измерения показали, что и солнце, и спираль лампы накаливания излучают невидимый глазом свет – с длинами волн меньше 400 нм (ультрафиолетовый) и больше 800 нм (инфракрасный).
Лампа накаливания излучает энергию в широком диапазоне длин волн, причем большая часть излучения приходится на тепловые (инфракрасные) волны. Доля видимого света в общем потоке излучения такой лампы составляет не более 3%. Согласно теории классической физики, если энергия излучения непрерывна, то любое тело с температурой выше абсолютного нуля должно излучать энергию и охлаждаться. Согласно той же классической физике, нагретая до 2500oС спираль должна в основном излучать видимый и ультрафиолетовый свет. Это противоречие теории и эксперимента было устранено, когда М.Планк предположил, что свет может излучаться не непрерывно, а только порциями – квантами. Энергия каждой порции связана с длиной волны:
E = hc / l , где h – постоянная Планка, с – скорость света, l – длина волны излучения.
В результате для нагретых тел были получены теоретические графики зависимости энергии от длины волны при разных температурах, совпадающие с экспериментальными [ ].
].
Согласно теории М.Планка, спектр излучения твердого тела будет казаться нам непрерывным из-за огромного числа близких по энергии квантов, в том числе и очень "слабых", возникающих при взаимодействии атомов и молекул. Спектр излучения возбужденного электричеством газа при небольшом давлении будет, наоборот, линейчатым , т.е. содержать не очень много различных по энергии квантов. Забегая вперед, скажем, что неон начинает излучать свет только в том случае, когда подводимая энергия становится достаточной для электронных переходов в его атомах, причем дальнейшее увеличение энергии обычно не приводит к появлению переходов с большей энергией. Эксперименты показывают, что при увеличении давления возбуждаемого электричеством газа в спектре его излучения за счет взаимодействия между атомами появляется все больше новых линий, и при высоком давлении газа спектр становится почти непрерывным.
Теория Планка не могла объяснить, почему кванты излучения неоновой лампы остаются неизменными при значительном увеличении электрического напряжения, т.е. подводимой к излучателю энергии. Оставались также необъяснимыми спектры излучения газов и паров, которые, в отличие от спектров твердого тела, представляют собой не радугу, а набор отдельных узких ярких полос. Очевидно, что необходимо было найти законы, по которым формируются кванты излучения в веществе. Когда система этих законов была создана в первой четверти нашего века, оказалось, что она позволяет объяснить и предсказать не только происхождение квантов, но и химические свойства элементов.
Строение атома. Квантовые числа
Дополнительно рекомендуется на эту тему учебник А.В.Мануйлов. "Химия, 9 и 11 классы. Три уровня обучения.: [  ]
]
Еще в 1865 г Николай Николаевич Бекетов [ ] [ 4] предположил, что атомы должны состоять из более мелких частиц, вращающихся относительно друг друга [5]. Такое строение, по его мнению, могло бы объяснить выделение энергии при химических реакциях.
] [ 4] предположил, что атомы должны состоять из более мелких частиц, вращающихся относительно друг друга [5]. Такое строение, по его мнению, могло бы объяснить выделение энергии при химических реакциях.
После открытия электрона в 1897 г. Джозефом Джоном Томсоном [ ] [ 6] им же была предложена первая атомная модель "пудинга с изюмом" – в положительную сферу вкраплены электроны (1903 г.).
] [ 6] им же была предложена первая атомная модель "пудинга с изюмом" – в положительную сферу вкраплены электроны (1903 г.).
В 1904 г. японский физик Хантаро Нагаока [ ] [ 7] предложил модель “ сатурноподобного ” атома, в котором электроны вращаются по кольцевой орбите вокруг положительного ядра.
] [ 7] предложил модель “ сатурноподобного ” атома, в котором электроны вращаются по кольцевой орбите вокруг положительного ядра.
Ученик Томсона Эрнест Резерфорд [  ] в результате знаменитых экспериментов по рассеянию золотой фольгой a -частиц "разделил" атом на маленькое положительное ядро и окружающие его электроны [ 8].
] в результате знаменитых экспериментов по рассеянию золотой фольгой a -частиц "разделил" атом на маленькое положительное ядро и окружающие его электроны [ 8].
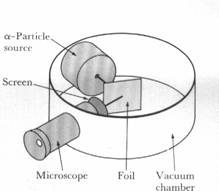
Схема эксперимента по рассеянию a -частиц
Однако, согласно законам классической механики и электродинамики, вращение электрона вокруг ядра должно сопровождаться электромагнитным излучением с непрерывным спектром. Это противоречило известным с 1880 г. линейчатым спектрам газов и паров элементов.
Многократно описанные в учебниках эксперименты Резерфорда – это сочетание исключительной аккуратности в работе с гениальной интуицией при интерпретации результатов. Как ни странно, усовершенствование экспериментальной техники и ее компьютеризации могли бы помешать получить подобные результаты.
Предположим, что в начале XX века Э.Резерфорд (1871-1937) и его молодые сотрудники Ганс Вильгельм Гейгер [  ] (1882-1945) и Эрнест Марсден (1889-1970) получили для своих экспериментов с рассеянием a -частиц компьтеризированную установку. Она легко воспроизвела бы основной результат, что наиболее вероятный угол рассеяния a - частиц на золотой фольге толщиной 4*10 –5 см составляет 0,87o . Для тех же чрезвычайно редких (1 из 20000 измерений) случаев рассеяния на угол более 90 o согласно центральной предельной теореме теории вероятностей достоверность эксперимента составляет 3*10 –2174 (это не опечатка!); поэтому компьютер со стандартной программой без малейшего сомнения отбросил бы такие “случайные ошибки”. И осталась бы наука без планетарной модели атома, по крайней мере на несколько десятков лет. Только великолепная интуиция Резерфорда позволила ему сделать вывод, что чрезвычайно редкие “случайные” результаты истинны, и на их основе изменить физическую модель атома (вместо “пудинга с изюмом” Дж.Томсона (1856-1940) подобие солнечной системы).
] (1882-1945) и Эрнест Марсден (1889-1970) получили для своих экспериментов с рассеянием a -частиц компьтеризированную установку. Она легко воспроизвела бы основной результат, что наиболее вероятный угол рассеяния a - частиц на золотой фольге толщиной 4*10 –5 см составляет 0,87o . Для тех же чрезвычайно редких (1 из 20000 измерений) случаев рассеяния на угол более 90 o согласно центральной предельной теореме теории вероятностей достоверность эксперимента составляет 3*10 –2174 (это не опечатка!); поэтому компьютер со стандартной программой без малейшего сомнения отбросил бы такие “случайные ошибки”. И осталась бы наука без планетарной модели атома, по крайней мере на несколько десятков лет. Только великолепная интуиция Резерфорда позволила ему сделать вывод, что чрезвычайно редкие “случайные” результаты истинны, и на их основе изменить физическую модель атома (вместо “пудинга с изюмом” Дж.Томсона (1856-1940) подобие солнечной системы).
Противоречие разрешил ученик Резерфорда Нильс Бор [  ] в 1913 г., разработав квантовую модель атома на основе квантовой теории излучения и поглощения света, созданной Максом Планком и Альбертом Эйнштейном. При этом удалось объяснить и рассчитать теоретически линейчатые спектры испускания атомов водорода, а также серии линий в рентгеновских спектрах элементов.
] в 1913 г., разработав квантовую модель атома на основе квантовой теории излучения и поглощения света, созданной Максом Планком и Альбертом Эйнштейном. При этом удалось объяснить и рассчитать теоретически линейчатые спектры испускания атомов водорода, а также серии линий в рентгеновских спектрах элементов.
Еще в 1885 г. швейцарский школьный учитель и одновременно доктор Базельского университета Иоган Бальмер предложил простую формулу для расчета частот линий испускания водорода в видимой области:
n = R(1/k 2 – 1/n 2 ) , где n – частота, R – постоянная [3,29*10 15 гц ], k = 2; n = 1,2,3,...
Позже в инфракрасной области были обнаружены другие серии спектральных линий с k = 3,4,5.
Бор выдвинул предположение, что атом водорода (система протон-электрон) может находиться только в определенных стационарных энергетических состояниях (электрон – на определенных орбитах), причем одно из них соответствует минимуму энергии и является основным (невозбужденным). Испускание или поглощение атомом энергии может происходить, согласно теории Бора, только при переходах электрона из одного энергетического состояния в другое (с одной орбиты на другую) [  ]. Для R в формуле Бальмера Бор нашел следующее выражение:
]. Для R в формуле Бальмера Бор нашел следующее выражение:
R = [(2  2 me 4 )/(ch3)] (1) , где m и e – масса и заряд электрона, c – скорость света в вакууме, h – постоянная Планка.
2 me 4 )/(ch3)] (1) , где m и e – масса и заряд электрона, c – скорость света в вакууме, h – постоянная Планка.
При этом Бор предсказал существование серии линий испускания в ультрафиолетовой области ( k = 1), которые затем были обнаружены в 1915 г. Теодором Лайманом .
В терминах "стационарных электронных оболочек (орбит)" удалось наглядно объяснить существование характеристического рентгеновского излучения для разных элементов, использованных в качестве анода в рентгеновской трубке.
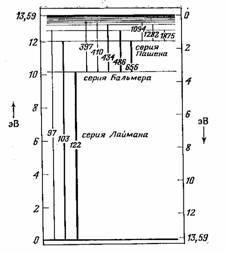
Рисунок 1. Уровни энергии и переходы в атоме водорода [ 9]
Впервые обнаруживший в 1910 г. характеристические лучи Чарльз Баркла (Англия) решил обозначить буквой K лучи с наибольшей проникающей способностью (наименьшей длиной волны), оставляя другие буквы для для возможных лучей с большей и меньшей проникающей способностью. Однако впоследствии удалось обнаружить только более мягкие лучи, получившие обозначения L, M, N. В результате систематических исследований рентгеновских спектров элементов Генри Мозли [ ] [ 10] (Англия) и Вальтер Коссель [
] [ 10] (Англия) и Вальтер Коссель [  ] (Германия) предложили в 1914 г оболочечную модель строения атома. Согласно этой теории на каждой из оболочек может содержаться несколько электронов с примерно одинаковой энергией. Тогда появление серий рентгеновских лучей можно легко объяснить переходами электронов между оболочками:
] (Германия) предложили в 1914 г оболочечную модель строения атома. Согласно этой теории на каждой из оболочек может содержаться несколько электронов с примерно одинаковой энергией. Тогда появление серий рентгеновских лучей можно легко объяснить переходами электронов между оболочками:
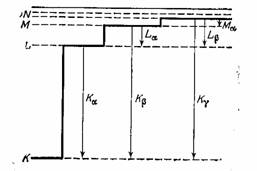
Рисунок 2. Появление серий излучения в рентгеновских спектрах [ 11].
Благодаря исследованиям рентгеновских спектров Мозли сумел определить заряды ядер элементов и показал, что они равны их порядковым номерам в периодической таблице. Кроме того, он предсказал существование еще не открытых элементов с номерами 43, 61, 72, 75.
Теория Бора позволяла очень точно вычислить положение линий в спектре испускания атомарного водорода. Однако она не могла предсказать соотношение интенсивностей линий даже в этой простейшей системе. Для систем, содержащих более одного электрона, например атома гелия, теория Бора уже не давала точных значений спектральных линий. Поэтому в 1925-26 гг. Вернером Гейзенбергом [ ] (Германия) и Эрвином Шредингером [
] (Германия) и Эрвином Шредингером [ ] (Австрия) была разработана новая теория квантовой (волновой) механики.
] (Австрия) была разработана новая теория квантовой (волновой) механики.
Основные положения квантовой механики
Вероятность нахождения электрона в заданной точке пространства и его энергия описываются волновой функцией . Волновая функция для данного электрона также называется орбитальной волновой функцией . Область пространства, где данный электрон может находиться с достаточно высокой вероятностью, называется орбиталью .
Согласно определению В.И.Пупышева [ 12], орбиталь – функция декартовых координат электрона, т.е. вектора с координатами x , y , z , не имеющая самостоятельного физического смысла . Смысл имеет лишь ее квадрат (а если волновая функция комплексна, то квадрат ее модуля), определяющий вероятность найти электрон в данной области пространства.
Следует учитывать, что изображаемые в учебниках “ орбитали ” – графики математической функции для решения уравнения Шредингера в одноэлектронном приближении, но ни в коем случае не физический (материальный) объект. Орбитали – математический уровень описания микрообъектов.
Для описания положения и энергии электрона в атоме используются четыре квантовых числа . Эти числа можно рассматривать как некие коэффициенты в решениях важнейшего в квантовой механике уравнения Шредингера. Важно понять, что квантовые числа в принципе невозможно описать никакими механическими и геометрическими аналогиями, поскольку постулаты квантовой механики не выводятся из законов классической физики .
Главное квантовое число n эквивалентно квантовому числу в теории Бора. Оно в основном определяет энергию электронов на данной орбитали :
E n = – (2  2 me 4 Z 2 )/(n2h2 ) = – 13,6 эВ * Z2 /n 2 (2)
2 me 4 Z 2 )/(n2h2 ) = – 13,6 эВ * Z2 /n 2 (2)
Обозначения те же, что и в формуле (1); Z – заряд ядра.
Допустимые значения:
Орбитальное квантовое число l определяет значение орбитального момента количества движения электрона на данной орбитали : [ l ( l + 1)] 1/2 h /2  .
.
Допустимые значения: 0, 1, 2, 3, ... , n -1.
Это квантовое число описывает поведение атомной орбитали при поворотах системы координат с центром на атомном ядре.
Исторически первые четыре значения имеют буквенные символы, произошедшие от спектроскопических терминов, использованных в 1890-е годы при описании спектров щелочных металлов: 0 – s ( sharp – резкий); 1 – p ( principal – главный); 2 – d ( diffuse – диффузный); 3 – f ( fundamental – фундаментальный). Эти буквы не являются сокращениями слов, описывающих "форму" орбитали . Изображаемые в учебниках "формы" орбиталей представляют собой графики функций, изображающие области математического пространства, где нахождение электрона данной орбитали наиболее вероятно. Эта область определяется квадратом соответствующей волновой функции.
Орбитальное магнитное квантовое число ml определяет значение составляющей проекции момента количества движения электрона на выделенное направление в пространстве: ml( h /2p). В отсутствие внешнего магнитного поля электроны на орбиталях с одинаковым значением орбитального квантового числа l энергетически равноценны (т.е. их энергетические уровни вырождены). Однако в постоянном магнитном поле некоторые спектральные линии расщепляются. Это означает, что электроны становятся энергетически неравноценными. Например, p-состояния в магнитном поле принимают 3 значения вместо одного, d-состояния – 5 значений. Допустимые значения m l для данного l: - l, ... -2, -1, 0, +1, +2, ... + l
Спиновое квантовое число ms связано с наличием собственного магнитного момента у электрона. В общем виде выражение для магнитного момента количества движения совпадает с таковым для орбитального момента:
[ ms ( ms + 1)] 1/2 h /2  .
.
Для электрона ms принимает только два значения: +1/2 и -1/2. Иногда для более наглядного объяснения понятия спина используют грубую аналогию – электрон представляют как летящий волчок (круговой ток, создающий собственное магнитное поле). Такая аналогия позволяет объяснить наличие спина ± 1/2 у электрона и протона, но не у нейтрона – частицы с нулевым зарядом.
Понятие "спин" не укладывается в наши " макропредставления " о пространстве. При всех способах его регистрации спин всегда направлен вдоль той оси, которую наблюдатель выбрал за исходную. Значение спина 1/2 означает, что электрон (протон, нейтрон) становится идентичным сам себе при обороте на 720o , а не 360o , как в нашем трехмерном мире. По выражению П.Дэвиса , мы в некотором смысле лишь наполовину воспринимаем мир, доступный электрону [  ] [ 13]. Некоторое представление о "двойном повороте" дает замкнутая двухвитковая петля с бусинкой на ней. В результате "двойного поворота" создаваемое электроном магнитное поле вдвое больше того, которое мог бы дать вращающийся заряженный шарик. Спин принято считать одним из фундаментальных свойств природы (т.е. он невыводим , как гравитация и электричество).
] [ 13]. Некоторое представление о "двойном повороте" дает замкнутая двухвитковая петля с бусинкой на ней. В результате "двойного поворота" создаваемое электроном магнитное поле вдвое больше того, которое мог бы дать вращающийся заряженный шарик. Спин принято считать одним из фундаментальных свойств природы (т.е. он невыводим , как гравитация и электричество).
Следует еще раз подчеркнуть, что приводимые во всех учебниках рисунки " орбиталей " выполнены в одноэлектронном приближении – как сумма возбужденных состояний атома водорода при допущении, что электронные пары ведут себя в атоме независимо. Разумеется, реальная картина взаимодействий в многоэлектронном атоме отличается от такой грубой модели.
Опубликовано:
1. Загорский В.В. Вариант изложения в физико-математической школе темы “Строение атома и Периодический закон”, Российский химический журнал (ЖРХО им. Д.И.Менделеева), 1994, т. 38, N 4, с.37-42
Загорский В.В. Строение атома и Периодический закон / "Химия" N 1, 1993 (прил. к газете "Первое сентября")
2. Загорский В.В. Замкнутый круг или спираль? (История химического образования в России) Школьное обозрение. N 2-3, 1999 г., с.6-11
3. Парменов К.Я. Химия как учебный предмет в дореволюционной и советской школе – М. Изд-во АПН РСФСР, 1963. – 359 с. , стр.256
4. Бекетов Н.Н. (1827-1911) , акад. Петерб . АН, термохимия, алюмотермия.
5. Смирнов Г.В. Досье эрудита - М: ЗАО МК-периодика, 2001. - 256 с., стр. 40
6. Отношение массы электрона к заряду более точно определил в 1896-1898 гг Вальтер Кауфман (1871-1947). Значение Кауфмана 0,54*10 -11 кг/Кл; Томсона от 0,49 до 0,9*10 -11 ;
современное 0,569*10 -11 кг/Кл. Однако Кауфман считал, что нельзя оперировать с сущностями, недоступными наблюдению (Э.Мах) .
7. Нагаока Хантаро (1865-1950), основатель японской физики, член АН СССР с 1930 г.
8. История эксперимента хорошо описана в книге: Вайнберг С. Открытие субатомных частиц: Пер. с англ. – М.: Мир, 1986. – 286 с., с.169-183
9. Хабердитцл В. Строение материи и химическая связь: Пер. с нем. – М.: Мир, 1974. – 296 с., с.52
10. Генри Мозли (1887-1915), англ. физик, создатель метода рентгеновской спектрроскопии с использованием кристалла в качестве дифракционной решетки. Определил физический смысл Периодического закона – свойства элементов зависят от заряда ядра. Пошел добровольцем на первую мировую войну, погиб в возрасте 28 лет.
11. Хабердитцл В. Строение материи и химическая связь: Пер. с нем. – М.: Мир, 1974. – 296 с., с.49
13. Витковская Н.М., Пупышев В.И. Квантовая химия В: Современное естествознание: Энциклопедия в 10 т. – М.: Флинта: Наука, 1999-2000., т.1. Физическая химия. – 328 с.
13. Дэвис П. Суперсила : Пер. с англ. – М.: Мир, 1989. – 272 с., с.41






