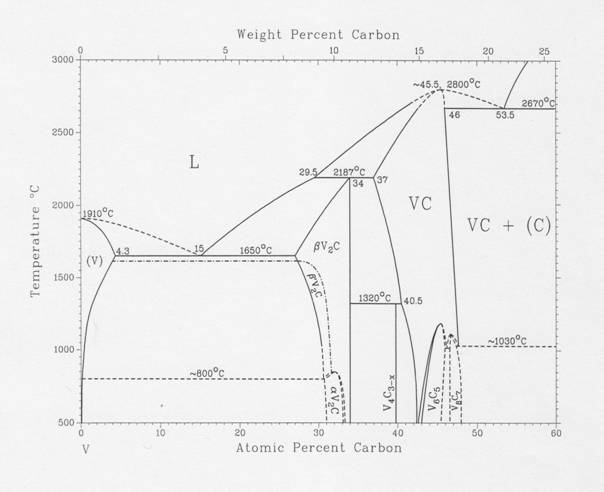
VC0.88(к). Диаграмма состояния системы V – C.
Диаграмма состояния системы V – C, представленная ниже, заимствована из справочника Mассальского [90MAS]. Как видно из рисунка, в широком интервале температур существуют две фазы карбидов ванадия, имеющих широкии области гомогенности, именно кубическая модификация VC1-x, устойчивая от комнатной температуры до точки ее плавления 3070 К с граничным максимальным содержанием углерода ~ VC0.88 , и фаза V2C1-x , устойчивая также до температуры ее плавления 2460 К.

Как было показано в ряде работ, при понижении температуры у этих высокотемпературных фаз наблюдается упорядочение в углеродных подрешетках с образованием новых фаз. В случае VC1-x образуется две фазы – V8C7 c температурой разупорядочения ~1400 К и V6C5 c температурой разупорядочения ~1350 К. В случае фазы V2C1-x при ~1100 К образуется низкотемпературная модификация такого же состава. Отметим, что экспериментальные измерения энтальпий разупорядочения VC1-x, проведенные Уильямсом методом ДТА [72WIL], показало, что эти величины очень малы. Ввиду этого, а также учитывая отсутствие надежных экспериментальных данных по теплоемкости и энтальпии образования этих низкотемпературных фаз, нам представляется целесообразным ограничиться рассмотрением в настоящем справочнике только стехиометрического состава гексагональной фазы V2C и нестехиометрического состава VC0.88 кубической фазы, который представляет собой предельный граничный состав по углероду.
VC0.88(к). Термодинамические свойства кристаллического и жидкого состава карбида ванадия VC0.88 (к,ж) при температурах 100 – 3000 К приведены в табл. VC.88_c. Значения постоянных, принятые для расчета термодинамических функций VC0.88(к,ж), приведены в табл.V.К1. За стандартное состояние VC0.88(к) в интервале 0 – 3070 К принята кубическая модификация (структурный тип NaCl).
Первые измерения теплоемкости и инкрементов энтальпии “cтехиометрических” составов кубического монокарбида ванадия были выполнены в работах [49SHO/KEL] и [49KIN] соответственно. Согласно современной фазовой диаграмме состав исследованных образцов представлял собой двухфазную смесь VC0.88 + С(графит). Исследованные в этих работах образцы были приготовлены нагреванием в вакууме при 1573 – 1623 К смеси порошка ванадия (с примесью 8 % углерода и следами других примесей) и расчетного количества чистой сажи. К сожалению, надежные данные о составе и возможных примесях образцов карбида ванадия отсутствовали, что привело к ошибочным результатам. Рассчитанное в [49SHO/KEL] значение стандартной энтропии Sº(298.15) = 28.33 Дж К моль оказалось завышенным на 10%. Более надежные измерения низкотемпературной теплоемкости однофазных образцов составов VC0.712 , VC0.83 и VC0.86 в интервале 60 – 298 К были получены в работах Черняева и др. [*67ЧЕР/ЩЕТ,*68ЧЕР/ЩЕТ]. Экстраполяция теплоемкости ниже 60 К, выполненная в этих работах, привела к хорошему согласованию с результатами измерений теплоемкости при гелиевых и водородных температурах ряда однофазных образцов, проведенных Лаундесом и др. [70LOW/FIN] (2 – 20 К). В этой работе были измерены теплоемкости четырех образцов VC0.87 , VC0.85 ,VC0.80 и VC0.76 в интервале 2 – 20 К. Соотношение V:C в образцах было установлено двумя способами - сравнением параметров кубической решетки с соответствующими данными Стормса [67STO] и аналогичным сравнением температур плавления этих образцов при зонной плавке с диаграммой состояния системы V – C [62STO/MCN]. Точность установления индекса x в формуле VCx была оценена в работе [70LOW/FIN] равной 0.01, а сумма небольших примесей азота и кислорода по данным химического анализа была меньше 0.01 %. Результаты измерений в этой работе [70LOW/FIN] параметров кубической решетки образцов VCx (а, Å) и температуры Дебая (θD, К) приведены ниже:
|
Образцы |
VC0.87 |
VC0.85 |
VC0.80 |
VC0.76 |
|
а0,Å |
4.165 |
4.162 |
4.151 |
4.134 |
|
θD,К |
690 |
712 |
636 |
635 |
Ниже приводятся результаты расчетов термодинамических функций при 298.15 К для трех составов, исследованных Черняевым и др. [*67ЧЕР/ЩЕТ], с учетом данных Лаундеса и др. [70LOW/FIN], (размерности Cp и S в Дж·К-1·моль –1, H(298) – H(0) в кДж·моль -1):
|
Состав |
Срº(298.15 K) |
Sº(298.15 K) |
Hº(298.15K)-Hº(0) |
|
VC0.712 |
30.4±0.3 |
25.65±0.3 |
4.59±0.4 |
|
VC0.83 |
31.8±0.4 |
25.19±0.3 |
4.61±0.4 |
|
VC0.86 |
32.0±0.3 |
25.06±0.3 |
4.60±0.4 |
Короткая экстраполяция этих данных к составу VC0.88 приводит к значениям термодинамических функций при 298.15К:
Ср°(298.15 К) = 32.1 ± 0.3 Дж·К-1 моль-1,
S°(298.15 К) = 25.1 ± 0.3 Дж·К-1моль-1,
H°(298.15 К) – H(0) = 4.60 ± 0.04 кДж· моль-1.
Отметим, что принятые значения для VC0.88 совпадают с рекомендованными в справочнике [*74МЕД/БЕР], однако несколько отличаются от приведенных в справочнике Вагмана и др. [82WAG/EVA] (по-видимому, из-за неучета данных [70LOW/FIN]).
Хотя измерения инкрементов энтальпии при высоких температурах (выше 298 К) были проведены в нескольких работах для образцов монокарбида ванадия с максимальным содержанием углерода, близким к границе фазового состава VC0.88 , после анализа точности этих измерений было решено провести совместную обработку только двух наиболее точных работ. К ним были отнесены данные работы Черняева, Летуна и Швейкина [*70ЧЕР/ЛЕТ], которые измерили инкременты энтальпии в интервале температур 298 – 1300 К на однофазном образце состава VC0.86 , на котором ранее были проведены измерения теплоемкости в интервале 60 - 300 К [*67ЧЕР/ЩЕТ]. Измерения инкрементов энтальпии были проведены на высокотемпературном негерметичном калориметре смешения, описанном в работе Серебренникова и Гельда [*54СЕР/ГЕЛ], на котором эти авторы провели весьма точные измерения энтальпии кремния в интервале 298 – 1550 К. Точность измерений энтальпии VC0.86 авторы [*67ЧЕР/ЩЕТ] оценили в 1%. Другой отобранной работой явились измерения инкрементов энтальпии образца VC0.88, которые были проведены Турчанином и др. [*74ТУР/ГУС] в интервале 1400 – 2450 К с точностью не хуже 1.5 %. Совместная обработка данных этих двух работ методом Шомейта показала хорошее согласование результатов измерений на стыке при 1300 – 1400 К - расхождения измерений инкрементов энтальпии не превышали при 1300 К 0.5 %. Выведенное уравнение для теплоемкости VC0.88 приведено в табл. V-K1.
Ввиду отсутствия экспериментальных данных по энтальпиям плавления карбидов ванадия и теплоемкостям их расплавов, эти величины были оценены способом, примененным нами для оценок этих величин для карбидов хрома. Для соединений VC0.88 и V2C энтропии плавления в качестве грубой оценки были приняты по величинам энтропий плавления металлического ванадия, без учета энтропии плавления углерода, т.е. для энтальпий плавления приняты 70 кДж·моль-1 и 110 кДж·моль-1 соответственно. Приближенные оценки теплоемкостей соответствующих расплавов карбидов ванадия были сделаны суммированием теплоемкостей жидких ванадия и углерода:
Cp(VC0.88) = Cp(Vж) + 0.88Cp(Сж) = 41.84 + 0.88×27 = ~ 65 и Cp(V2C) = 2Cp(Vж) + Cp(Сж) = 83.68 + 27 = ~110 Дж·К-1моль-1.
Термохимические величины для VC0.88(к,ж).
Константа равновесия реакции VC0.88(к,ж)=V(г)+0.88C(г) вычислена по значению ΔrHº(0 K) = 1244.120 ±3.9 кДж·моль-1, соответствующему принятой энтальпии образования VC0.88(к,ж):
ΔfHº(VC0.88, к, 298.15 K) = ‑105 ± 3 кДж·моль-1.
Принятое значение получено обработкой результатов измерений, представленных в таблице V.Т13.
Особого пояснения требует работа [63MAH], в которой приведено значение ΔfHº(VC0.88, к, 298.15 K) = -101.8 ± 1.7 кДж·моль-1 , отличающееся от приведенного в таблице на 2.0 кДж·моль-1 . Отличие связано с тем, что в цитируемой работе были использованы значения энтальпий образования V2O4(к) и V2O5(к), равные –1427.6 ± 1.7 и ‑1550.6 ± 2.1 кДж·моль-1, соответственно (получено в той же лаборатории ранее [61MAH/KEL]). Принятые в нашем издании величины составляют –1438 ± 4 и ‑1556 ± 3 кДж·моль-1, соответственно. Отличия связаны с двумя обстоятельствами, а именно: (1) с появлением в литературе двух новых работ [73CHA/KLE, 89LAV/CHE], соизмеримых по точности с работой [61MAH/KEL], и (2) с необходимостью учета того обстоятельства, что, по-видимому, во всех экспериментах с участием V2O4(к) следует считаться с возможностью присутствия не только его основного состояния (моноклинного), но также и высокотемпературной (тетрагональной) модификации с параметрами перехода: Ttr = 340 K, DtrH = 8.6 кДж·моль-1 (cм. таблицу V.К1). Приводимый ниже материал соответствует предположению, что в экспериментах обеих работ [61MAH/KEL, 63MAH] образующаяся V2O4(к) находилась в одной и той же модификации, а именно: высокотемпературной, т.е. тетрагональной, энтальпия образования которой в данном издании принята равной ‑1428±3 кДж·моль-1.
Пересчет сделан в предположении, что образующаяся смесь окислов имеет состав VO2.361, средний между получаемыми в эксперименте величинами (от 2.326 до 2.396). Соответствующее этому предположению уравнение реакции имеет вид:
7.1942*VC(к) + 15.6870*О2 = V2O4(к) + 2.5971*V2O5(к) + 7.1942*СО2
В рамках сделанных предположений сумма изменений энтальпий образования V2O4(к) + 2.5971*V2O5(к) (0.4+2.5971*5.4) равна изменению энтальпии образования 7.1942 молей VC(к), что составляет -2.0 кДж на моль VC(к). Погрешность приводимой величины, главным образом, связана с неточностями принятых в вычислениях энтальпий образования V2O4(к) и V2O5(к).
В работе [74JOH] приводятся результаты выполненных автором калориметрических измерений энтальпии сожжения во фторе препарата состава VС0.787(к). Приводимое в работе значение энтальпии образования составляет: ΔfHº(VC0.787, к, 298.15 K) = ‑107.1 кДж·моль-1 . Работа изложена очень кратко; даже такой формальный критерий качества результата, как погрешность полученного значения энтальпии образования в работе отсутствует. Интересно, что в работе приводится результат более ранних измерений автора для другого состава: ΔfHº(VC0.847, к, 298.15 K) = ‑106.9 кДж·моль-1. Автор работы полагает, что такая близость величин при довольно разных составах является свидетельством ошибочности измерений. На этом основании при выборе значения этому результату был придан несколько меньший вес по сравнению с результатом, полученным в работе [63MAH].
Из остальных представленных в таблице результатов наибольшего доверия заслуживает результат, полученный в работе [73STO/LOW]; этот результат разумно согласуется с принятой рекомендацией. Следует сказать несколько слов по поводу результатов работы [91COL/NAV]. Дело в том, что приводимые в таблице погрешности базируются на приведенных в цитируемой работе погрешностях в величинах ΔfGº(VC0.73, к) и на оцененных нами неточностях термодинамических функций. Реальные погрешности, очевидно, заметно больше, так как они должны включать в себя и неточности в энтальпиях образования веществ, использованных в работе в качестве реперов (Та2С, Мо2С и Cr23C6). По-видимому, авторы [91COL/NAV] отдавали себе отчет по этому поводу, т.к. приводимое в работе значение ΔfHº(VC0.73, к, 298.15 K) = ‑96.8 ± 5.1 кДж·моль-1. авторы считают оценкой. Это значение согласуется с нашей рекомендацией довольно хорошо, особенно с учетом большого различия в составах препаратов.
Принятое значение представляет собой среднее из двух согласующихся результатов, следующих из работ [63MAH, 74JOH]. По изложенным соображениям работе [74JOH] придан несколько меньший вес. Погрешность оценена.
Причины несогласия с принятым значением результатов работ [62FUJ/GOK, *69ВОЛ/ШАБ] не ясны.
Принятому значению соответствует величина:
ΔfHº(VC0.88, к, 0 K) = ‑104.096 ± 3.0 кДж·моль-1 .
Класс точности, оцененный в соответствии с погрешностями принятых величин: 5-E.
Авторы
Бергман Г.А. bergman@yandex.ru
Гусаров А.В. a-gusarov@yandex.ru
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
17.10.11
|
Таблица V.K1. Принятые значения термодинамических величин для ванадия и его соединений в кристаллическом и жидком состояниях
Примечания: Срo(T) = а + bТ – сТ-2 + dТ2 (в Дж×K‑1×моль‑1) V(к): а d×10+6 = 3.057 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Таблица V.Т13. К выбору величины энтальпии образования VС0.88(к,ж) (кДж·моль-1, Т = 298.15 К)
1) В экспериментах получались смеси указанных окислов с суммарным составом в интервале от VO2.326 до VO2.396 (см. текст); приведенное уравнение соответствует среднему значению, т.е. составу VO2.361 . 2) В работе получены результаты для 8 препаратов указанного состава; заметной зависимости теплового эффекта от состава не выявлено; в таблице приведено среднее. 3) Погрешность не приведена. 4) В работе результаты отнесены к препарату VC(к). 5) В работе температуры не указаны; принято по [91COL/NAV]. 6) Измерения выполнены с препаратом состава VC0.73(к). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [*54СЕР/ГЕЛ] | Серебренников Н.Н., Гельд П.В. -"Теплоекость кремния и силицида железа при 298-1500 К." Труды Уральского политехнич. ин-та, Свердловск, 1954, No.49, с.125-144 |
| [*63ВОЛ/ГЕЛ] | Волкова Р.М., Гельд П.В. -"Теплоты образования кубических карбидов ванадия." Изв. вузов. Цв. мет., 1963, 6, No.5, с.89-94 |
| [*67ЧЕР/ЩЕТ] | Черняев В.С., Щетникова Е.Н., Швейкин Г.П., Кренцис Р.П., Гельд П.В -"Влияние температуры и состава на некоторые термодинамические характеристики карбидов ванадия." Изв. АН СССР, неорган. материалы, 1967, 3, No.5, с.789-796 |
| [*68ЧЕР/ЩЕТ] | Черняев В.С., Щетников Е.Н., Швейкин Г.П., Гельд П.В. -"Теплоемкость кубической моноокиси и оксикарбида ванадия." Изв. АН СССР, неорган. материалы., 1968, 4, No.12, с.2117-2123 |
| [*69ВОЛ/ШАБ] | Волейник В.В., Шабденов Б.А. -"Равновесие соединений металлов и неметаллов с солевыми расплавами. Определение термодинамических свойств соединения ванадия методом э.д. с."'Физ. химия и электрохимия расплавл. солей и шлаков Ч. 1.' , Киев: Наук. думка, 1969, с.157-162 |
| [*70ЧЕР/ЛЕТ] | Черняев В.С., Летун С.М., Швейкин Г.П. -"Теплосодержание кубических карбидов и окислов ванадия при высоких температурах." Тр. Уральского политехнического ин-та (Свердловск), 1970, No.186, с.167-168 |
| [*74МЕД/БЕР] | Медведев В.А., Бергман Г.А., Алексеев В.И., Васильев В.П., Гурвич Л.В., Юнгман В.С.и др. -"Термические константы веществ. Справочник в 10 выпусках. Выпуск 7, части 1 и 2. Москва, изд. ВИНИТИ, с.1-771 |
| [*74ТУР/ГУС] | Турчанин А.Г., Гусева Е.А., Морозов В.В., Болгар А.С., Фесенко В.В. -"Энтальпия и теплоемкость нестеохиометрических монокарбидов ванадия при высоких температурах." Изв. АН СССР, неорган. материалы, 1974, 10, No.9, с.1619-1622 |
| [49KIN] | King E.C -"High-temperature heat contents of vanadium carbide and vanadium nitride." J. Amer. Chem. Soc., 1949, 71, p.316-317 |
| [49SHO/KEL] | Shomate C.H., Kelley K.K. -"Heat capacities at low temperatures and entropies of vanadium carbide and vanadium nitride." J. Amer. Chem. Soc., 1949, 71, p.314-315 |
| [61MAH/KEL] | Mah A.D., Kelley K.K. -"Heats and Free Energies of Formation of Oxides of Vanadium." U. S. Bur. Mines, Rept. Invest., 1961, p.11 |
| [62FUJ/GOK] | Fujishiro S., Gokcen N.A. -"Thermodynamic properties of VC at high temperatures." J. Electrochem. Soc., 1962, 109, No 9, p. 835-838 |
| [62STO/MCN] | Storms E.K., McNeal R.J. -"The vanadium-vanadium carbide system." J. Phys. Chem., 1962, 66, p.1401-1408 |
| [63MAH] | Mah A.D. -"Heats and free energies of formation of vanadium nitride and vanadium carbide."'US Bur.Mines.' , 1963, No.6177 |
| [67STO] | Storms E.K. -'The Refractory Carbides.' , New York, London: Acad.press, 1967 |
| [70LOW/FIN] | Lowndes D.H., Finegold L., Lye R.G. -"Low temperature specific heat of vanadium carbide." Phil. Mag., 8, 1970, 21, No.170, p.245-255 |
| [72WIL] | Williams W.S., “Influence of vacancy ordering on thermophysical properties of vanadium carbide.”-High Temp.-High Pressur.,1972, 4, N6, p.627-638 |
| [73CHA/KLE] | Charlu T.V., Kleppa O.J. -"High Temperature Combustion Calorimetry. II. Enthalpies Formation of Vanadium Oxides." High Temp. Sci., 1973, 5, No.5, p.260-268 |
| [73STO/LOW] | Storms E.K., Lowe A., Baca E., Griffin J. -"The vaporization behavior of the defect carbides. III. The vanadium - carbon system." High Temperature Science, 1973, 5, No.4, p. 276-290 |
| [74JOH] | Johnson G.K. -"Vanadium carbide."'Chem.engineering.div.termochem. studies.' , No.ANL-8121 Argonne: Argonne Nat.Lab., 1974, p. 34-35 |
| [82WAG/EVA] | Wagman D.D., Evans W.H., Parker V.B., Schumm R.H., Halow I., Bailey S.M., Churney K.L., Nuttall R.L. -'The NBS Tables of Chemical Thermodynamic Properties. J. Phys. and Chem. Ref. Data.' , 1982, 11, No.2, p.1-393 |
| [89LAV/CHE] | Lavut E.G., Chelovskaya N.V. -"Use of an Ekectric Furnace in a Calorimetric Bomb for Combustion in Oxygen. Determination of the Standard Molar Enthalpy of Formation of V2O2." J. Chem. Thermodyn., 1989, 21, No.7, p.765-771 |
| [90MAS] | Massalski T.B. -'Binary Alloy Phase Diagrams.' , Ohio: ASM Int., Materials Park, 1990 |
| [91COL/NAV] | Coltters R.G., Nava Z. -"High-temperature thermodynamic properties of the vanadium carbides V2C and VC0.73 determined using a galvanic cell technique." Met. Trans.B, 1991, 22, No.5, p.661-668 |