Сульфид ванадия
VS(к,ж). Диаграмма состояния системы V – S.
Несмотря на большое количество экспериментальных исследований различных сульфидов ванадия и их твердых растворов диаграмма состояния V – S не свободна от противоречивых данных. Трудности исследования этой системы обусловлены сравнительно высокими давлениями диссоциации сульфидов (особенно богатых серой), близости кристаллических структур сульфидов, наложением полей их устойчивости, кинетическими затруднениями достижения равновесных состояний.
Диаграмма состояния системы V – S, представленная ниже, заимствована из справочника Массальского [90MAS].
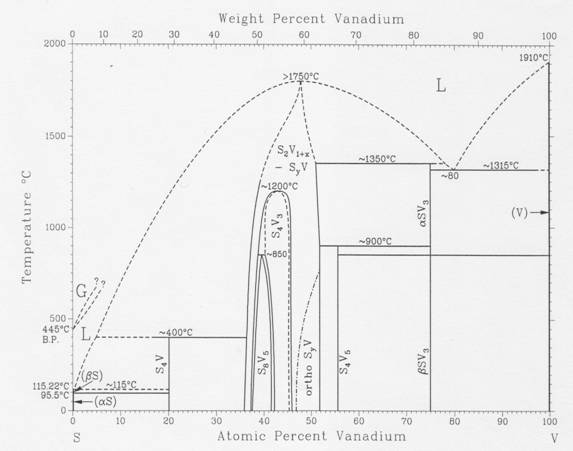
Рассмотрим место сульфидов ванадия в этой системе по мере роста содержания в них серы. Тетрагональный сульфид V3S (структурный тип Ni3P; далее используем сокращение с.т.) имеет полиморфное превращение в другую тетрагональную модификацию (с.т. V3Si) при 1200 К и плавится инконгруэнтно при ~ 1620 К. Тетрагональный сульфид V5S4 (c.т. собственный) претерпевает при 1170 К эвтектоидный распад на твердые сульфиды V3S и VS. В области гексагональных твердых растворов VS1±x - V2S1-y выклинивается низкотемпературная ромбическая модификация VS (c.т.MnP), имеющая заметную область твердых растворов. При нагревании до ~ 900 К наблюдается почти одновременное протекание двух фазовых переходов – структурного перехода из ромбической модификации в гексагональную (с.т.NiAs) и магнитного перехода типа металл – диэлектрик. Из этих же твердых растворов выклиниваются также два других поля сульфидов ванадия : поле моноклинной фазы V3S 4 (c.т. родственный NiAs) с точкой разупорядочения 1470 К и поле другой моноклинной фазы V5S8 (с.т. сверхструктура к NiAs) с точкой разупорядочения 1120 К. Так называемый сесквисульфид ванадия V2S3 при температурах ниже 1120 К попадает в поле фазы V5S8, а при температурах выше 1120 К представляет собой гексагональный твердый раствор стехиометрического состава, устойчивый до температуры плавления ~2000 К (в случае повышенного давления). При быстром охлаждении V2S3 проходит закаливание этой фазы, что происходило при измерениях инкрементов энтальпии в работе Болгара и др. [*80БОЛ/ВОЛ]. Таким образом V2S3 можно рассматривать как твердую фазу переменного состава и проводить термодинамические расчеты, для чего необходимо знание энтальпии образования этого состава.
Наконец, сульфид ванадия с наибольшим содержанием серы моноклинный VS 4 (минерал патронит) плавится инконгруэнтно при ~670 К с образованием раствора ванадия в жидкой сере и твердого сульфида ванадия приблизительного состава V2S.
Рассмотрение диаграммы состояния системы V – S и имеющихся экспериментальных данных по термодинамическим свойствам сульфидов ванадия показывает, что в настоящее время целесообразно в данной работе рассмотреть два наиболее важных тугоплавких сульфида ванадия – моносульфид VS(к) и сесквисульфид ванадия V2S3(к), ограничив интервал температур до температур близких к их плавлению (~2000 К). Выбор VS(к) обусловлен практической важностью этого сульфида, наличием данных по кристаллическим структурам и фазовым превращениям VS, а также по термохимическим данным, включая равновесие испарения и теплоту испарения VS. Аналогичные основания для выбора V2S3(к) - наличие измерений инкрементов энтальпии до довольно высоких температур (1100 К) в работе Болгара и др. [*80БОЛ/ВОЛ] и термохимических величин для V2S3(к). Рассмотрение других сульфидов ванадия нецелесообразно вследствии полного отсутствия для них экспериментальных данных, а также из за сравнительно низких температур их устойчивости.
VS(к). Термодинамические свойства кристаллического сульфида ванадия при температурах 298.15 – 2000 К приведены в табл. VS–с. Значения постоянных, принятые для расчета термодинамических функций VS(к), приведены в табл.V.К1. За стандартное состояние VS(к) в интервале 0 – 900 К принята ромбическая модификация (структурный тип MnP), а выше 900 K –гексагональная (структурный тип NiAs) [*74МЕД/БЕР].
Как было указано выше, диаграмма состояния V – S исследована недостаточно полно. Из приведенного выше рисунка видно, что при низких температурах ромбическая фаза имеет заметную область гомогенности. С ростом температуры ширина области гомогенности этой фазы уменьшается и ее состав приближается к стехиометрическому.
Единственные измерения теплоемкости сульфида ванадия были проведены в работе Тсубокавы [59TSU] в интервале 500 – 1040 К. К сожалению, состав образца не был установлен химическим анализом, а только по рентгеновским данным; результаты измерений теплоемкости представлены только в виде мелкомасштабного графика. Представляет интерес заключение автора этой работы, что при ~ 800 К начинается ускорение роста теплоемкости VS, которое завершается λ-кривой с острым максимумом при ~900 К, после которого теплоемкость падает с минимумом при 950 К. В работе [59TSU] вычислена энтальпия фазового перехода второго рода по величине аномальной части теплоемкости и получено значение 615 кал·моль–1 = 2.6 кДж·моль–1 VS. Природа этого фазового перехода изучалась в ряде работ. В частности в работе Лосева и др. [*83ЛОС/АБР] методом ДТА была определена близкая величина Ttr (880 K) и доказана природа этого перехода как переход типа металл-диэлектрик. По-видимому, в этом случае на магнитный переход происходит наложение структурного превращения ромбической модификации в гексагональную. Это сказывается в том, что энтропия фaзового перехода, равная 2.9 Дж·K–1·моль–1 , в 2.2 раза больше энтропии аналогичного магнитного перехода VSe, определенной в этой же работе [59TSU].
Рассмотрение данных по абсолютным значениям теплоемкости VS в работе [59TSU] показывает, что эти измерения в интервале 500 – 800 К совершенно не согласуются с измерениями, которые были проведены в надежных работах по теплоемкости моносульфидов переходных металлов (измерения [59TSU] завышены более чем в 2 раза). Использованная в [59TSU] калориметрическая установка, описанная в недоступном нам “Техническом отчете RITU” [53HIR/MAE], не была использована в каких либо других опубликованных работах. Поэтому было решено расчеты термодинамических функций VS(к) выполнить на основании оценок величин стандартной энтропии и теплоемкостей и с учетом результатов измерений инкрементов энтальпии V2S3(к), проведенных Болгаром и др.[*80БОЛ/ВОЛ] в интервале 298 – 1100 К.
Оценки стандартных энтропии VS(к) при 298 К, выполненные с помощью различных классических аддитивных методов расчета, приводят к существенному разбросу результатов: от 50.2 (метод Келли) до 63.2 Дж·K–1·моль–1 (метод Латимера, 1953 г). Однако применение других методов оценки, предложенных позднее с использованием более надежных экспериментальных значений энтропий, приводят к более “кучным“ результатам: Метод Латимера с поправками Ходаковского [*71НАУ/РЫЖ] и Цагарейшвили [*77ЦАГ] дает значение 51.9 Дж·K–1·моль–1, а аддитивный расчет по методу Киселева и др. [*98КИС/БОГ] с эмпирической поправкой приводит к значению 52.7 Дж·K–1·моль–1 . Выбранное усредненное значение Sº(298.15 K) = 51.5 Дж·K–1·моль–1 принимается с погрешностью ± 3 Дж·K–1·моль–1. Оцененные значения термодинамических функций VS(к) при 298. 15 К приводятся ниже:
Ср°(298.15 К) = 48.0 ± 2 Дж·К-1 моль-1,
S°(298.15 К) = 51.5 ± 3 Дж·К-1моль-1,
H°(298.15 К) – H(0) = 8.5 ± 0.2 кДж· моль-1.
Теплоемкости ромбической модификации при 298 – 900 К и гексагональной модификации VS(к) при 900 – 2000 К были оценены при помощи линейных уравнений с учетом измерений инкрементов энтальпии для сесквисульфида ванадия (т.е. для сульфида состава V1S1.5), проведенных Болгаром и др. [*80БОЛ/ВОЛ] в интервале 298 – 1100 К. Точность принятых значений теплоемкости для VS(к) можно оценить в 3 – 5 %. В расчетах термодинамических функций VS(к) учитывается значение энтальпии фазового перехода [59TSU] (2.6 ± 0.5 кДж·моль-1), отнесенного к температуре максимума λ-кривой теплоемкости (900 ± 20 К ).
Погрешности вычисленных значений Ф°(Т) для VS(к) при 298.15, 500, 1000, 1500 и 2000 К оцениваются в 3, 4, 5, 6 и 8 Дж·K–1·моль-1 соответственно. Термодинамические свойства VS(к) в справочных изданиях ранее не рассчитывались.
Термохимические величины для VS(к).
Константа равновесия реакции VS(к) = V(г) + S(г) вычислена по значению ΔrHº(0 K) = 1013.616 ± 5.6 кДж·моль-1, соответствующему принятой энтальпии образования VS(к):
ΔfHº(VS, к, 298.15 K) = -225 ± 5 кДж·моль-1.
Это значение получено в работе Льюиса, О’Хара и др. [87LEW/O'H] в результате калориметрических исследований методом сожжения во фторе при давлении фтора около 0.7 МПа тщательно охарактеризованного образца орторомбического моносульфида ванадия VS1.043 Основная калориметрическая реакция описывается уравнением:
VS1.043(к) + 5.629F2(г) = VF5(г) + 1.043SF6(г).
В результате обработки данных семи экспериментов в работе [87LEW/O'H] найдено значение ΔfHº(VS1.043, к, 298.15 K) = -230.3 ± 2.2 кДж·моль-1. Энтальпия образования стехиометрического моносульфида ванадия оценена в работе [87LEW/O'H] по уравнению
ΔfHº(VS, к, 298.15 K) ≈ (2/2.043)ΔfHº(VS1.043, к, 298.15 K) = -225 ± 5 кДж·моль-1.
Таким образом, полученная величина соответствует энтальпии образования одного моля нестехиометрического сульфида состава V0.979S1.021. Несмотря на приближенный характер такого расчета, найденное значение следует считать надежным в пределах оцененной авторами [87LEW/O'H] погрешности. Оно принимается в настоящем издании.
Принятому значению соответствует величина:
ΔfHº(VS, к, 0 K) = -224.508 ± 5.0 кДж·моль-1 .
Класс точности, оцененный в соответствии с погрешностями принятых величин: 6-E.
Авторы:
Бергман Г.А. bergman@yandex.ru
Горохов Л.Н. gorokhov-ln@yandex.ru
Версия для печати


