Оксид ванадия
VO(к,ж). Фазовая диаграмма системы V – О.
Фазовая диаграмма системы V – О, представленная ниже, заимствована из справочника Массальского [90MAS].
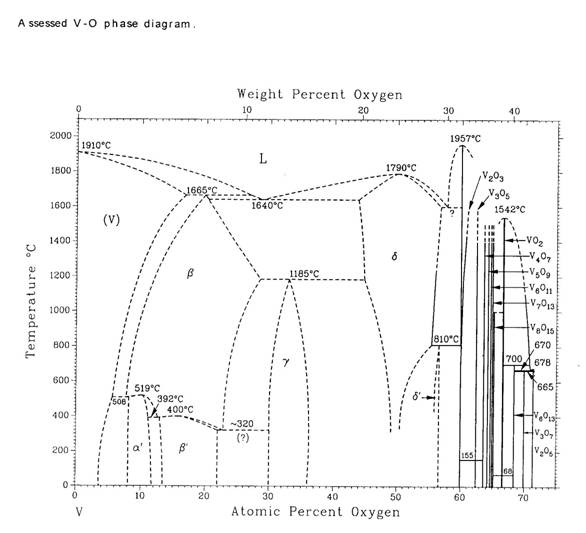
Изучению фазовой диаграммы системы V-O посвящен целый ряд исследований, обзор которых выполнен в работе Давыдова и Ремпеля [*2009ДАВ/РЕМ]. Как сообщают авторы [*2009ДАВ/РЕМ] в системе V-O существуют по данным разных работ от 21 до 25 соединений и фаз. Большинство из них – оксиды VnO2n-1 c n=2-8, VO2, VnO2n+1 с n=2,3 и 7 с содержанием кислорода 60 ат.% и более. Эти оксиды хорошо изучены и, как правило, не имеют областей гомогенности. В отличие от них оксиды ванадия с содержанием кислорода менее 55 ат.% имеют широкие области гомогенности.
Самой широкой областью гомогенности обладает δ-фаза – кубический монооксид ванадия VxOz, содержащий большое количество структурных вакансий одновременно как в подрешетке ванадия, так и в подрешетке кислорода. Известно несколько работ, посвященных определению содержания вакансий в кубическом монооксиде ванадия, так например, по данным [70BAN/REE] в стехиометрическом VO1.000 содержится по ~15.2 ат.% вакансий в обеих подрешетках. Согласно собственным результатам, полученным авторами [*2009ДАВ/РЕМ], при температуре 1600 К кубический монооксид ванадия существует в интервале составов VO0.90-VO1.30. При понижении температуры область гомогенности сужается и при температуре ниже 600 К вероятно уходит в сверхстехиометрическую область составов VOy (y>1.0). Температура конгруэнтного плавления стехиометрического VO составляет 2063 К.
Помимо δ-фазы в системе V-O в области, близкой к ванадию, существует объемно-центрированный тетрагональный твердый раствор кислорода в ванадии, содержащий от 10 до 22-25 ат.% О ( β-фаза, устойчивая в интервале температур ~600-1900 К ).
Сведения о положении фазовых границ моноклинной γ-фазы ( ≈V2O ), содержащей не более 37 ат.% О и образующейся по перитектоидной реакции, крайне противоречивы. Согласно [65STR] γ-фаза не имеет области гомогенности и устойчива ниже температуры ~1430 К. Тогда как по данным других авторов γ-фаза обладает довольно широкой областью гомогенности от VO0.39 до VO0.54 и устойчива вплоть до температуры 1620 К. По обе стороны от γ-фазы располагаются обширные двухфазные области β+γ и γ+δ, а при Т>1620 К существует двухфазная область β+δ (см. обзор [*2009ДАВ/РЕМ] ).
Двуокись ванадия VO2 (33.333 ат.% V + 66.667 ат.% O) имеет некоторую область гомогенности, температурные границы которой до сих пор точно не установлены. При 1073 К эта область простирается от VO1.90 до VO2.00 по данным [62KOS/TOK] и от VO1..99 до VO2.02 по данным [67KOS]. При 1600 К согласно работе [67KAT/HAS] границы области существования двуокиси ванадия лежат в пределах VO1.996 - VO2.00. Температура конгруэнтного плавления стехиометрического VO2.00 составляет 1818 К по данным [47COO].
Помимо соединений и фаз, стабильных при атмосферном давлении, известны различные модификации V2O5, существующие при высоких давлениях. Существование фазы высокого давления β-V2O5 обнаружено в работе [77SUZ/SAI]. Согласно результатам термического анализа [*88ВОЛ/ГОЛ] переход β-V2O5 в стабильную α-модификацию сопровождается большим экзотермическим эффектом при ~ 673 К. Авторы работы [*2001ФИЛ/ЗИБ] подтвердили наличие широкой области стабильности β-V2O5 в интервале давлений 5.0-8.0 ГПа, а также установили образование новой модификации высокого давления B-V2O5 при p~8.0 ГПа и Т>1023 К, которая при атмосферном давлении переходит в α-V2O5.
Рассмотрение диаграммы состояния системы V-О приводит к выводу, что для термодинамических расчетов высокотемпературных равновесий с участием конденсированных фаз оксидов ванадия достаточно иметь термодинамические данные для четырех оксидов ванадия - VO, V2O3, V2O4 и V2O5, для которых имеются необходимые термодинамические константы. Отметим, что для низкотемпературных кристаллических фаз оксидов ванадия соответствующие данные практически отсутствуют и поэтому эти фазы не рассматриваются в имеющихся справочниках термодинамических функций.
VO(к, ж). Термодинамические свойства кристаллического и жидкого оксида ванадия стехиометрического состава в стандартном состоянии при температурах 100 – 5000 К приведены в табл. VO_c.
Значения постоянных, использованные при вычислении термодинамических функций, приведены в табл. V.К1. В справочнике за стандартное состояние VO(к) принимается кубическая модификация (структурный тип NaCl) с беспорядочным расположением вакансий в обеих подрешетках.
При T ≤ 298.15 К термодинамические функции VO(к) вычислены по данным Черняева и др. [*68ЧЕР/ЩЕТ], измеривших теплоемкость образца VO0.99 (наряду с образцами VO0.86, VO1.24 и VO1.30) в интервале температур 59 – 299 К. Измерения выполнены с помощью низкотемпературного адиабатического калориметра; погрешность измерений не превышала 1%. Теплоемкость оксида ванадия монотонно увеличивается с ростом температуры, что служит достаточно надежным подтверждением отсутствия каких либо превращений в изученном интервале температур. Экстраполяция теплоемкости ниже 59 К проведена с использованием дробно-рационального уравнения шестой степени, выведенного по данным [*68ЧЕР/ЩЕТ], и значению θD = 600 К, которое было оценено на основании величин θD(TiO, к) = 650 ± 50 К и θD(NbO, к) = 550 К, полученных Оказом и Кеезомом [75OKA/KEE]. В результате экстраполяции получено значение Sº(VO, к, 59 К) = 1.5 Дж×K‑1×моль‑1.
Стандартные значения термодинамических величин при 298.15 К, принятые по данным [*68ЧЕР/ЩЕТ], составляют:
Cpº(298,15 К) = 38.56 ± 0.3 Дж×K‑1×моль‑1
Sº(298.15 К) = 33.6 ±0.3 Дж×K‑1×моль‑1
Hº(298.15 К) - Hº(0)=6.0 ± 0.03 кДж×моль‑1
Результаты измерений теплоемкости VO(к) в работе Тодда и Бонниксона [51TOD/BON] (55 – 296 К; чистота образца составляла 98.2%) весьма существенно отличаются от данных [*68ЧЕР/ЩЕТ]. Это касается и температурного хода теплоемкости и еë значений. Кривая Cpº(Т) по данным [51TOD/BON] лежит значительно выше (на ~9-18 %) данных [*68ЧЕР/ЩЕТ] во всем интервале температур. Кроме того в работе [51TOD/BON] отмечена некая аномалия в области 168-191 К, подобная той, что наблюдалась в работе Андерсона [36AND2] при измерении теплоемкости V2O3. По мнению авторов [51TOD/BON] эта аномалия может быть связана либо с незавершенностью реакции при получении образца VO(к) из металлического V и V2O3, либо с диспропорционированием полученной моноокиси ванадия.
При Т>298.15 К для теплоемкости VO(к) принято уравнение ( табл. V.К1), полученное совместной обработкой данных по энтальпии в работах Орра [54ORR] (394-1698 К) и Черняева и др. [*70ЧЕР/ЛЕТ] (400 – 1300 К) для VOx(к), x = 0.86, 1.105, 1.18 и 1.24 и приведенных к составу VO1.00. Измерения энтальпии в обеих работах выполнены с использованием высокотемпературных калориметров смешения. Погрешность измерений в работе [*70ЧЕР/ЛЕТ] не превышала 1%; рентгеновское исследование всех образцов подтвердило полную гомогенность препаратов, параметры решетки которых хорошо согласуются с литературными данными. В работе [54ORR] был использован образец, на котором проводились низкотемпературные измерения теплоемкости авторами [51TOD/BON]. Следует отметить, что при совместной обработке были исключены значения энтальпии при 394 К по данным [54ORR] и при 400 К по данным [*70ЧЕР/ЛЕТ], так как расхождение между ними составляет ~15%, в то время как при остальных температурах значения Hº(T) - Hº(298.15 К) расходятся на 1-3%. Значения теплоемкостей при Т>1700 К получены экстраполяцией результата совместной обработки до температуры плавления. Измерения энтальпии оксидов ванадия VO1+Х, где х=1.044-1.475 при 4-х значениях Т=455, 647.4, 847.7 и 1048.1 К в работе [*61ЯКО/КРА] и измерения теплоемкости VO1±Х в работе [91TSU/TOS] (324-920 К), представленные в графическом виде, не учитывались.
Температура плавления VO(к) принята равной 2063 ± 10 К по данным Александера и Карлсона [71ALE/CAR] для образца с содержанием примесей ~ 0.1 %. Менее точные значения получены в работах [62BRA/MAR] (2103 К) и [65STR] (2033 К). Энтальпия плавления VO(к) (48±5 кДж×моль‑1) оценена с использованием значения энтропии плавления ΔmS=23.2 Дж×K‑1×моль‑1 для TiO, изоструктурного VO (структурный тип NaCl). Для теплоемкости VO(ж) принято значение 70±7 Дж×K‑1×моль‑1, равное экспериментально измеренной Cpº(ж) для TiO(ж).
Погрешности приведенных в табл. VO_c значений Φº(T) при 298.15, 500, 1000, 1500, 2000, 3000 и 5000 К оцениваются в 0.2, 0.5, 1, 2, 3, 6 и 11 Дж×K‑1×моль‑1 соответственно.
Ранее термодинамические функции VO(к, ж) вычислялись в справочниках Келли [60KEL] (до 2000 К), Барина и Кнаке [73BAR/KNA] (до 1973 К), Панкратца [82PAN] (до1800 К) и Чейза [98CHA] (до 3500 К). Расхождения между термодинамическими функциями VO(к, ж), приведенными в табл. VO_c и в перечисленных справочниках составляют 2- 9 Дж×K‑1×моль‑1 в значениях Φº(T), что объясняется использованием в настоящей работе данных [*68ЧЕР/ЩЕТ] и [*70ЧЕР/ЛЕТ], а также различием в оценке теплоемкости VO(ж).
Термохимические величины для VO(к).
Константа равновесия реакции VO(к)=V(г)+О(г) вычислена по значению ΔrHº(0 K) = 1192.548 ± 5.6 кДж·моль-1, соответствующему принятой энтальпии образования VО(к):
ΔfHº(VО, к, 298.15 K) = ‑434.5 ± 5.0 кДж·моль-1.
Принятое значение получено обработкой результатов калориметрических исследований методом сожжения, представленных в таблице V.Т2. Основная трудность, возникающая при определении энергии сгорания ванадия и его оксидов состоит в том, что при сгорании образуются, как правило, смеси оксидов. В обеих указанных работах в таблице это обстоятельство учитывалось путем введения поправок на основании сведений о составе продуктов реакции. Наиболее детально эта проблема рассмотрена в работе Ма и Келли [61MAH/KEL]. В работе Ма и Келли на основании рентгенографического анализа было установлено, что оксид ванадия VO(к) при сгорании превращается в смесь V2O3(к) и V2O4(к), причем преимущественно образуется V2O3(к). В рассматриваемой работе по данным нескольких экспериментов определялась зависимость энергии сгорания от состава смеси и проводилась экстраполяция энергии к тому или иному стехиометрическому составу. Принятое нами значение энтальпии образования VO(к) получено усреднением данных работ [*59ВОЛ/АРИ] и [61MAH/KEL] с учетом принятого в настоящем справочнике значения энтальпии образования V2O3(к). При усреднении придан более высокий вес работе Ма и Келли [61MAH/KEL].
Принятому значению соответствует величина:
ΔfHº(VO, к, 0 K) = ‑431.580 ± 5.0 кДж·моль-1 .
Класс точности, оцененный в соответствии с погрешностями принятых величин: 5-D.
Авторы:
Аристова Н.М., Горохов Л.Н. gorokhov-ln@yandex.ru
Версия для печати


