Нитрид ванадия
VN(к,ж). Диаграмма состояния системы V – N.
Диаграмма состояния системы V – N, представленная ниже, заимствована из справочника Массальского [90MAS].
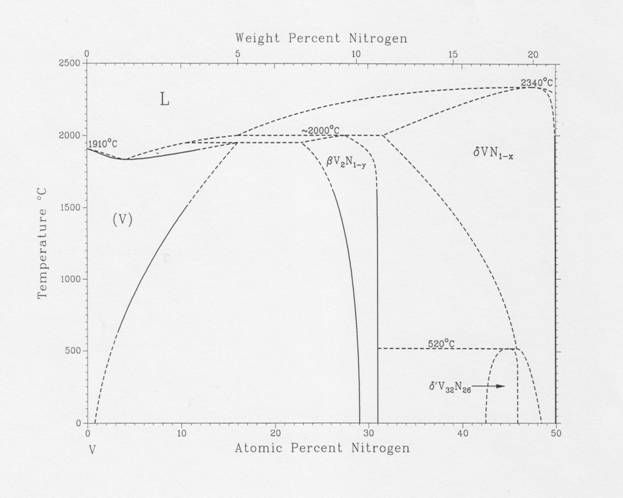
Как видно из рисунка, в широком интервале температур существуют две фазы нитридов ванадия - кубическая модификация VN1-x и гексагональная модификация V2N1-x . Кроме них с знаком вопроса на диаграмме состояния показан нитрид V32N26, о котором известно, что он имеет пространственную группу P42/mnm и при нагревании до ~800 К претерпевает перитектоидное разложение на смесь нитридов VN1-x и V2N1-x . Кубическая фаза мононитрида ванадия VN1-x при комнатной температуре имеет узкую область гомогенности, однако при нагревании эта область быстро расширяется до составов, близких к VN0.7 (при температуре ~ 2000ºС). Выше 2000ºС граница области гомогенности резко идет в сторону стехиометрического состава VN1, который плавится с разложением при 2340ºС. Гексагональная фаза V2N1-x имеет более узкую область гомогенности, плавится при 2000ºС с перитектическим разложением на жидкий ванадий и высокотемпературную фазу VN1-x .
В настоящем справочнике расчеты термодинамических свойств проведены для стехиометрического состава VN и нестехиометрического субнитрида V2N0.93.
VN(к,ж). Термодинамические свойства кристаллического и жидкого нитрида ванадия в стандартном состоянии при температурах 100 –3000 К приведены в табл. VN–с. Значения постоянных, принятые для расчета термодинамических функций VN(к,ж), приведены в табл.V-К1. За стандартное состояние VN(к) в интервале 0 – 2620 К принята кубическая модификация (структурный тип NaCl), [25BEC/EBE],[*70ВИН/ДМИ]. При 8.8 К у нитрида ванадия обнаружен переход из сверхпроводящего состояния в нормальное [68PES/GOL].
При Т<298.15 K термодинамические функции VN(к) вычислены по результатам измерений теплоемкости VN в работах Хьюма и др. [71HUL/WAL] (при Т<20 K), Ловчинова и др. [84LOV/MAD] (2 – 11 K) и Шомейта и Келли [49SHO/KEL] (52 – 296 K), а также значений теплоемкости, определенных графической интерполяцией в интервале 20 – 52 К. По результатам этого расчета принимаются следующие значения термодинамических функций при стандартной температуре:
Ср°(298.15 К) = 37.98 ± 0.3 Дж·К-1 моль-1,
S°(298.15 К) = 37.43 ± 0.3 Дж·К-1моль-1,
H°(298.15 К) – H(0) = 6.240 ± 0.05 кДж· моль-1.
При Т>298.15 К инкременты энтальпии VN(к) были измерены в работах Кинга [49KIN] (408 – 1611 К) и Литвиненко и др. [*80ЛИТ/БОЛ] (388 – 1391 K). В работе Кинга измерения проводились на том же образце, что и в работе Шомейта и Келли [49SHO/KEL], а в работе [*80ЛИТ/БОЛ] – на 3 нестехиометрических образцах VN0.97, VN0.86 и VN0.79 . Для совместной обработки данных двух работ результаты, полученные Литвиненко и др. [*80ЛИТ/БОЛ], были пересчитаны к стехиометрическому составу VN1. Погрешности измерений [49KIN] и [*80ЛИТ/БОЛ] были приняты одинаковыми (± 1%). Экстраполяция теплоемкости по полученному методом Шомейта трехчленному уравнению выше 1600 К приводит к разумным значениям теплоемкости; при 1600 и 2600 К – к ~ 60 и ~70 Дж·К-1моль-1 соответственно.
Попытки определения температуры плавления нитрида ванадия были предприняты в ряде работ. Фридерих и Ситтиг [25FRI/SIT] проводили измерения при нагревании прессованного образца VN0.98 (состава 78 %V и 21.1 % N) в атмосфере водорода и фиксировали точку плавления по изменению электропроводности при ~2320 К; при этой температуре наблюдалось выделение азота. Фарбер и Сривастава [73FAR/SRI] в масс-спектрометрическом исследовании термического разложения нитрида ванадия наблюдали существование твердого VN до 2412 К. По-видимому, более надежные данные были получены Эттмайером и Киффером [74ETT/KIE], которые провели 13 измерений температуры плавления VN двумя методами в атмосфере азота при давлениях от 0.5 до 60 атм и определили значение 2623 ± 20 К . В настоящей работе по этим данным принимается округленное значение 2620 ± 100 К. При 2619 К согласно расчетам авторов справочника JANAF [98CHA] происходит разложение VN на жидкий ванадий и азот. Для вычисления термодинамических функций гипотетического жидкого VN в узком интервале температур (2620 – 3000 К) нами проведены приближенная оценка энтальпии плавления VN 27 кДж· моль-1 , принимая энтропию плавления VN равной энтропии плавления металлического ванадия (10.5 Дж·К-1моль-1), и оценка теплоемкости расплава VN ( 67 Дж·К-1моль-1).
Погрешности вычисленных значений Ф°(Т) при 298.15, 500, 1000, 1500, 2000 и 3000 оцениваются в 0.3, 0.5, 0.7, 0.9 , 1.3 и 4 Дж·К-1моль-1 соответственно.
Термохимические величины для VN(к,ж).
Константа равновесия реакции VN(к,ж)=V(г)+N(г) вычислена по значению ΔrHº(0 K) = 1201.316 ± 2.7 кДж·моль-1, соответствующему принятой энтальпии образования VN(к,ж):
ΔfHº(VN, к, 298.15 K) = ‑219.0 ± 1.0 кДж·моль-1.
Принятое значение получено обработкой результатов измерений, представленных в таблице V.Т12.
Особого пояснения требует работа [63MAH], в которой приведено значение ΔfHº(VN, к, 298.15 K) = ‑51.88 ± 0.2 ккал·моль-1 = ‑217.1 ± 0.8 кДж·моль-1, отличающееся от приведенного в таблице на 1.4 кДж·моль-1 . Отличие связано с тем, что в цитируемой работе были использованы значения энтальпий образования V2O4(к) и V2O5(к), равные –1427.6 ± 1.7 и –1550.6 ± 2.1 кДж·моль-1, соответственно (получено в той же лаборатории ранее [61MAH/KEL]). Принятые в нашем издании величины составляют –1436.2 ± 4 и ‑1556 ± 3 кДж·моль-1, соответственно. Отличия связаны с двумя обстоятельствами, а именно: (1) с появлением в литературе двух новых работ [73CHA/KLE, 89LAV/CHE], соизмеримых по точности с работой [61MAH/KEL], и (2) с необходимостью учета того обстоятельства, что, по-видимому, во всех экспериментах с участием V2O4(к) следует считаться с возможностью присутствия не только его основного состояния (моноклинного), но также и высокотемпературной (тетрагональной) модификации с параметрами перехода: Ttr = 340 K, DtrH = 8.6 кДж·моль-1 (cм. таблицу V.К1). Приводимый ниже материал соответствует предположению, что в экспериментах обеих работ [61MAH/KEL, 63MAH] образующаяся V2O4(к) находилась в одной и той же модификации, а именно: высокотемпературной, т.е. тетрагональной, энтальпия образования которой в данном издании принята равной ‑1428±3 кДж·моль-1.
Пересчет сделан в предположении, что образующаяся смесь окислов эквимолярна, что примерно соответствует приводимым в [63MAH] результатам: эквимолярная смесь соответствует составу VN2.25 , что хорошо соответствует полученному в эксперименте интервалу: от VN2.231 до VN2.296 . В рамках сделанных предположений сумма изменений энтальпий образования V2O4(к)+V2O5(к) (0.4+5.4) равна изменению энтальпии образования 4х молей VN, что и отражает приведенная в таблице величина. Погрешность приводимой величины, главным образом, связана с неточностями принятых в вычислениях энтальпий образования V2O4(к) и V2O5(к).
В работе [*85ЛУК/СИД] имеются результаты ЭДС измерений для двух составов, находящихся в области гомогенности VN(к), а именно: V0.536N0.464 и V0.562N0.438. Обработка этих результатов с использованием III закона термодинамики приводит к совпадающим результатам (-219.5±1.0 при обработке по III закону термодинамики) при практически отсутствующем температурном ходе величин, что указывает на высокую надежность измерений. Совпадение результатов измерений для заметно различающихся составов может считаться разумным доводом для того, чтобы принять эту величину и для стехиометрического состава, что и было сделано.
Принятое значение представляет собой среднее из двух согласующихся результатов, следующих из работ [63MAH, *85ЛУК/СИД]. Погрешность оценена.
Причины несоответствия принятому значению величин, полученных в работах [*69ВОЛ/ШАБ, 73FAR/SRI] не ясны.
В справочнике [98CHA] приводятся результаты обработки данных [19SLA/HIG], отнесенные авторами работы [98CHA] к равновесию 2VN(к)=2V(к)+N2. Эти результаты не имеют термодинамического смысла, т.к. на диаграмме фаз системы V-N нет участка сосуществования фаз VN(к) и V(к). Приводимый в [98CHA] результат: ΔfHº(VN, к, 298.15 K) = ‑172 кДж·моль-1.
Принятому значению соответствует величина:
ΔfHº(VN, к, 0 K) = ‑216.325 ± 1.0 кДж·моль-1 .
Класс точности, оцененный в соответствии с погрешностями принятых величин: 5d.
Авторы
Бергман Г.А. bergman@yandex.ru
Гусаров А.В. a-gusarov@yandex.ru
Версия для печати


