NiS (к, ж). Система никель-сера

Исследование системы Ni – S отличается сложностью по сравнению с системой Co – S, поскольку температуры плавления высокотемпературных фаз NiS и NiS2 выше, чем для соответствующих фаз сульфидов кобальта, а равновесные давления паров серы над сульфидами никеля в точках плавления также выше, чем над аналогичными сульфидами кобальта. Ввиду этого данные различных авторов по температурам фазовых переходов сульфидов никеля на диаграммах состояния могут значительно различаться (иногда на десятки градусов).
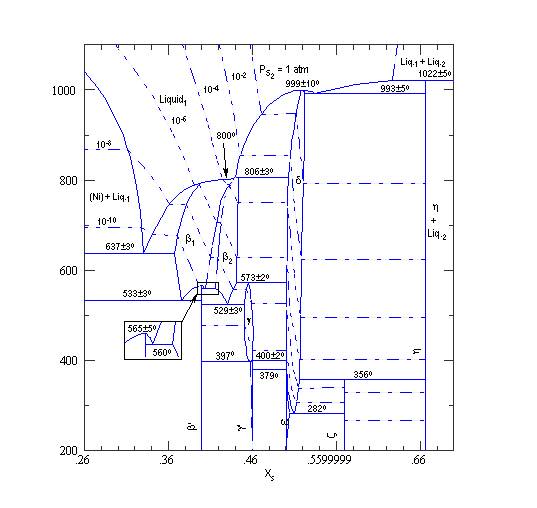
Рис.1. Диаграмма состояния системы Ni - S [78LIN/HU]
На рис.1 приведена диаграмма состояния системы Ni – S по данным Лина, Хью и Чанга [78LIN/HU] (температура приведена в градусах Цельсия, а по оси абсцисс – состав в молекулярных %). В настоящем справочнике расчеты термодинамических функций проведены для наиболее высокоплавких сульфидов никеля - это NiS (или Ni1-yS) c точкой конгруэнтного плавления, лежащей в интервале 1250 – 1272 К (последнее значение относится к составу NiS1.03 , [78LIN/HU] ), - это NiS2, который при атмосферном давлении плавится инконгруэнтно с разложением на Ni1-yS и пары серы, а при давлении в ~100 атм. и температуре 1295 ± 5 К [75ARN/MAL] плавится с разложением на две жидкие фазы (см. ниже), а также сульфид состава Ni3S2 , который устойчив в интервале 0 – 838 К, а выше этой температуры существует в виде фазы Ni2±yS3 с довольно широкой областью гомогенности (стехиометрический состав плавится при 1064 ± 3 К).
Кроме указанных соединений в системе Ni – S установлено существование нескольких других фаз, устойчивых в узких температурных интервалах. Это сульфиды Ni4S3 (устойчив при 803 – 1073 К) , Ni6S5 (устойчив при 673 – 786 К) и Ni7S8 (устойчив ниже 629 К); их термодинамические свойства в данном справочнике не приводятся, в частности, поскольку эти свойства недостаточно изучены. На рис.1 различные сульфиды никеля обозначены следующими греческими буквами: a-NiS - e, Ni1-yS - d, NiS2 - h, Ni3S2 - b1 и b1, Ni4S3 - b2, Ni6S5 - g , Ni7S8 - x.Перечислим названия некоторых минералов сульфидов никеля: a-NiS – миллерит, b-NiS – никколит, NiS2 – ваэсит, Ni3S2 - хизлевудит,Ni3S4 – полидимит, Ni7S8 - годлевскит (последние два минерала в справочнике не рассматриваются).
NiS(к, ж). Термодинамические свойства кристаллического и жидкого сульфида никеля в стандартном состоянии при температурах 100-4000 К приведены в табл. NiS_c. Значения постоянных, принятые для расчета термодинамических функций, приведены в табл. Ni.1.
В справочнике за стандартное состояние NiS(к) в интервале 0 – 660 К принята гексагональная (ромбоэдрическая) a-модификация (пространственная группа R3m, минерал миллерит), а при температурах 660 – 1250 К - другая гексагональная b-модификация (пространственная группа P63/mmc, структурный тип никелина, NiAs [69НЕМ/ЗВИ]).
При Т<298.15 термодинамические функции α-NiS вычислены по измерениям теплоемкости, проведенным Уиллером и Келли (52 – 296 К) [64WEL/KEL]. Исследованный образец содержал 64.56% Ni (теоретич. 64.68%) и 0.12% примесей, не растворимых в кислотах; точность измерений теплоемкости авторы оценивают в 0.3%. Экстраполяция теплоемкости ниже 52 К привела к значениям Sº(52 К) = 3.07 Дж×K‑1×моль‑1, Sº(298.15 К) = 52.95 ± 0.4 Дж×K‑1×моль‑1 и Hº(298.15 К) - Hº(0) = 8.576 ± 0.030 кДж×моль‑1, принимаемых в справочнике.
Наиболее надежные измерения теплоемкости миллерита (α-NiS) в интервале 298–660 К были получены Гронволем и Столеном [95GRO/STO] для 3 образцов сульфида (A, B и C) на высокотемпературном адиабатическом калориметре, описанном ранее [94GRO/STO]. Калориметр был проградуирован по измерениям теплоемкости стандартного образца α-Al2O3. Точность измерений температуры составляла 0.05 К в диапазоне 300 – 900 К и 0.1 К при1000 К, погрешности вводимой энергии нагрева образца не превышали 0.025 %, суммарная точность измерений теплоемкости α-NiS (вне области аномалии) оценена авторами работы не хуже 0.3 %, а точность определения инкрементов энтальпии и энтропии составила ~0.2 %. Масса образцов A и B была равна по 125 г., а теплоемкость пустого калориметра составляла примерно 60 % от теплоемкости калориметра + образца. При нагревании миллерита в интервале 605 – 615 К обнаружена незначительная аномалия теплоемкости, связанная по мнению авторов работы с способом получения образцов, с их близостью к стехиометрическому составу, с их отжигом при разных температурах. В работе [95GRO/STO] показано, что выше 615 К теплоемкость сначала уменьшается (почти до значения, полученного линейной экстраполяцией Ср от 600 К), а затем начиная с 640 К растет, достигая максимума при 660 К. Авторы [95GRO/STO] провели интегрирование аномальной части теплоемкости образцов миллерита A и B во всем интервале от 600 до 670 К и отнесли полученные энтальпии превращения к изотермическому тепловому эффекту при 660 К, составившему для образцов соответственно 6590 и 6592 кДж×моль‑1. Результаты измерений теплоемкости миллерита представлены в статье в виде таблицы от 298.15 К до 660 К с шагом 20 К. По этим данным было выведено трехчленное уравнение для Ср(Т), см. табл. Ni.1. Результаты более ранних и, по-видимому , менее точных измерений, которые были проведены в работах Тильдена [03TIL], Ферранте [76MAH/PAN] и Конара и др. [77CON/SRI], отклоняются от данных [95GRO/STO] не более чем на 1 %. Для энтальпии превращения α-NiS в β-NiS принято по данным [95GRO/STO] значение 6.591 ± 0.05 кДж×моль‑1 ; менее точные результаты были получены в работах [36BIL/WEI] (2.6 кДж×моль‑1), [77CON/SRI] (6.444 кДж×моль‑1) и [80DUB/CLA] (5.86 ± 0.36 кДж×моль‑1).
Выбор пятичленного уравнения для теплоемкости β-NiS в интервале 660 – 1000 К по данным [95GRO/STO] и оценочного линейного уравнения при 1000 – 1250 К описан в разделе по расчету термодинамических функций β-NiS. Температура плавления β-NiS принята равной 1250 ± 10 К по работе [78LIN/HU]. Энтальпия плавления 30 кДж×моль-1 оценена – принята равной энтальпии плавления сульфида железа FeS. Теплоемкость расплава NiS 70 ± 5 Дж×K‑1×моль‑1 принята по данным калориметрической работы Вайсбурда и Зединой [71ВАЙ/ЗЕД]. В этой работе измерения проводились капельным методом в калориметре смешения в интервале температур от Tm до 1723 К.
Погрешности вычисленных значений F°(T) для NiS(к, ж) при 298.15, 1000, 2000 и 3000 K оцениваются в 0.5, 1.5, 5 и 10 Дж×K‑1×моль‑1 соответственно. Расхождения между термодинамическими функциями NiS(к), приведенными в табл. NiS_c и в справочниках Миллса [74MIL] (до 900 К) и ДЖАНАФ [85CHA/DAV] (до 3400 К) соствляют ~3 Дж×K‑1×моль‑1 в значениях Ф°(Т).
Для настоящего справочника стандартная энтальпия образования NiS(к) принимается на основании калориметрических исследований Кемика и Клеппы [86СЕМ/KLE]:
DfH°(NiS, к, 298.15 К) = -94 ± 2 кДж×моль‑1.
Исследования, из которых можно определить энтальпию образования NiS(к), проводились методами калориметрии [1886THO, 71АРИ/МОР, 86CEM/KLE] и равновесия [25JEL/ZAK, 29SCH/RAU]. Равновесные результаты мало надежны (только 2 температуры и большая погрешность в [25JEL/ZAK] и отсутствие первичной информации в [29SCH/RAU]); эти результаты в дальнейшем не рассмaтриваются и при выборе величины не учитываются. Результаты калориметрических измерений суммированы в табл. Ni.20. В работе [1886THO] проведено только два измерения, полнота осаждения NiS(к) не установлена, осажденный NiS(к) не охарактеризован (осадок мог содержать гидратированную воду). Поэтому результат работы [1886THO] недостаточно надежен, а приводимая погрешность занижена. Более корректные термохимические результаты получены Ария и др. [71АРИ/МОР]. Образующийся по твердофазной реакции в калориметрической ячейке NiS(к) охарактеризован фазовым анализом, однако выполнено всего три параллельных измерения, энтальпия реакции, полученная как разность больших величин, составляла от них всего 6-7%. По-видимому погрешность этих измерений близка к 3 кДж×моль‑1 или хуже. Наиболее надежно и корректно выполнено термохимическое изучение образования NiS(к) по твердофазной реакции в [86CEM/КLE]. Авторами дана исчерпывающая характеристика исходных веществ; с помощью предварительных опытов установлена полнота протекания реакции, что было подтверждено после калориметрического опыта рентгенографически. Поэтому рассчитываемая из этих данных энтальпия образования представляется наиболее надежной. Поскольку сама реакция в этой работе проводилась при Т = 1100 К, когда равновесной является высокотемпературная модификация, авторы отнесли полученный ими результат именно к этой модификации. Принятое в данном документе значение DfH°(NiS, к, 298.15 К) есть комбинация полученной в [86CEM/КLE] величины с величиной DtrH°(a-NiS à b-NiS, 298.15 К) = 5.719 кДж×моль‑1, принятой в данном издании.
Константа равновесия реакции NiS(к) = Ni(г) + S(г) вычислена по значению DrH°(0) = 790.274 ± 2.8 кДж×моль‑1, соответствующему принятым энтальпиям образования.
Авторы
Бергман Г.А. bergman@yandex.ru
Гусаров А.В. a-gusarov@yandex.ru
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
18.06.07
|
Таблица Ni.1 Принятые значения термодинамических величин для никеля и его соединений в кристаллическом и жидком состояниях
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Таблица Ni.20. К выбору энтальпии образования NiS(к) (кДж×моль‑1 ; Т = 298.15 К).
1) Использовано DtrH°(a-NiS à b-NiS, 298.15 К) = 5.719 кДж×моль‑1 (данное издание). |
| [1886THO] | Thomsen J. - Thermochemische Untersuchungen.Leipzig: Verlag von J.A.Barth, 1882-1886, 1886 |
| [03TIL] | Tilden W.A. - Trans. Roy. Soc. (London), 1903, 201, p.37 |
| [25JEL/ZAK] | Jellinek K., Zakowski J. - Z. anorg. und allgem. Chem., 1925, 142, No.1-2, S.1-53 |
| [29SCH/RAU] | Schenck R., Raub E. - Z. anorg. und allgem. Chem., 1929, 178, S.225-251 |
| [36BIL/WEI] | Biltz W., Weibke F., Ehrlich P., Meisel K. - Z. anorg. und allgem. Chem., 1936, 228, p.285-296 |
| [64WEL/KEL] | Weller W.W., Kelley K.K. - 'U.S. Bur. Mines, Rept. Invest. 6511.', Vashington, 1964, No.6511, p.1-7 |
| [69НЕМ/ЗВИ] | Немойтин М.А., Звинчук Р.А. - Вестн. Ленинград. ун-та, 1969, No.10, с.88 |
| [71АРИ/МОР] | Ария С.М., Морозова М.П., Павлинова Л.А. - Ж. физ. химии, 1971, 45, с.2385-2386 |
| [71ВАЙ/ЗЕД] | Вайсбурд С.Е., Зедина И.Н. - Ж. физ. химии, 1971, 45, No.8, с. 2038-2040 |
| [74MIL] | Mills K.C. - 'Thermodynamic data for inorganic sulphides, selenides and tellurides.', London: Butterworths and Co., 1974, p.1-845 |
| [75ARN/MAL] | Arnold R.G., Malik O.P. - Econ.Geol.Bull.Soc.Geol., 1975, 70, No.1, p.176-182 |
| [76MAH/PAN] | Mah A.D., Pankratz L.B. - 'U. S. Bur. Mines, Rept. Invest. No 668.', Washington, 1976, No.668, p.1-125 |
| [77CON/SRI] | Conard B.R., Sridhar R., Warner J.S. - 'Paper presented at the 106th AIME annual meeting, Atlanta, Georgia, U.S.A.', 1977 |
| [78LIN/HU] | Lin R.Y., Hu D.S., Chang Y.A. - Metall Trans., 1978, B, 9, N4, 531-538 |
| [80DUB/CLA] | Dubusc M., Claire Y., Rey J., C.R. Hebd. Seances Acad. Sci., Ser. C, 1980, v.290, N5, p.89-92 |
| [85CHA/DAV] | Chase M.W., Davies C.A., Downey J.R., Frurip D.J., McDonald R. A., Syverud A.N. - 'JANAF thermochemical tables. Third edition. J. Phys. and Chem. Ref. Data.', 1985, 14, No.Suppl. 1, p.1-1856 |
| [86CEM/KLE] | Cemic L., Kleppa O.J. - Geochim. Cosmochim. Acta., 1986, 50, No.8, p.1633-1641 |
| [86CEM/КLE] | Cemic L., Kleppa O.J. - Geochim. Cosmochim. Acta., 1986, 50, No.8, p.1633-1641 |
| [86СЕМ/KLE] | Cemic L., Kleppa O.J. - Geochim. Cosmochim. Acta., 1986, 50, No.8, p.1633-1641 |
| [94GRO/STO] | Gronvold F., Stolen S., Tolmach P., Westrum E.F.- J.Chem.Thermodyn, 1994, 25, N9, p.1089-1118 |
| [95GRO/STO] | Gronvold F., Stolen S. - Thermochim. Acta, 1995, 266, p.213-229 |