Mn3C(к). Термодинамические свойства кристаллического карбида тримарганца в стандартном состоянии при температурах 100 – 1500 K приведены в табл. Mn3C_c.
Значения постоянных, использованные для расчета термодинамических функций, приведены в табл. Mn.1. За стандартное состояние Mn3C(к) в интервале 0 – 1310 K принимается ромбическая модификация [54KUO/PER], структура высокотемпературной модификации неизвестна. В работах [57PIC/FLA], [57PIC/FLA2] получен и исследован карбид состава β – Mn3C. Сделан вывод о том, что β-фаза с гексагональной сингонией менее устойчива, чем ромбическая α-фаза.
Природа перехода при 1310 K авторами [42SOU/MOO] не обсуждается. По данным [54KUO/PER] ромбический Mn3C претерпевает распад при 1322 K по схеме Mn3C → тв. р-р C в Mn + Mn5C2. До появления результатов новых исследований расчет термодинамических функций Mn3C проведен по данным [42SOU/MOO].
При T < 298.15 K термодинамические функции Mn3C(к) вычислены по результатам измерений теплоемкости в работе Келли и Мура [43KEL/MOO] (52 – 295 K). Образец содержал 98.8 % Mn3C и 1.2 % Mn; коррекция теплоемкости на содержание марганца по оценке авторов [43KEL/MOO] составила от – 0.30 до + 0.13 %. По данным анализа содержание углерода и марганца составило 6.71 и 93.15 % соответственно при теоретическом 6.79 и 93.21 %. Экстраполяция теплоемкости к 0 K, выполненная с помощью функции Дебая-Эйнштейна, дает Sº(52K) = 5.48 Дж×K‑1×моль‑1. Приведенные в таблице значения Sº(298.15K) и Hº(298.15K) - Hº(0) имеют погрешности 2 Дж×K‑1×моль‑1 и 0.2 кДж×моль‑1 соответственно.
Для теплоемкости Mn3C(к) в интервале температур 298.15 – 1310 K принято уравнение, выведенное с использованием значений Cpº(298.15 K) = 93.5, Cpº(500 K) = 107 и Cpº(1100 K) = 128.5 Дж×K‑1×моль‑1. Приведенные значения получены усреднением результатов измерений энтальпии в работах Саусарда и Мура [42SOU/MOO] (471 – 1309 K; измерения выполнены на образце [43KEL/MOO] и Болгара и др. [77БОЛ/ЛИТ] (400 – 1100 K; погрешность измерений не превышала 1.1 %; характеристика образца не приведена). В интервале температур 1310 – 1500 K для теплоемкости) принято постоянное значение в соответствии с данными [42SOU/MOO] (1321 – 1420 K).
Температура (1310 ± 2 K) и энтальпия (13.14 ± 2.0 кДж×моль‑1) перехода приняты по данным [42SOU/MOO].
Термодинамические функции рассчитаны до 1500 K. Погрешности вычисленных значений Фº(Т) при 298.15, 1000 и 1500 К оцениваются в 1.5, 3 и 5.5 Дж×K‑1×моль‑1 соответственно. Расхождения между термодинамическими функциями Mn3C(к), приведенными в справочнике Барина [95BAR] (298.15 – 1200 К) и в табл. Mn.1, не превышают 1%.
Термохимические величины для Mn3C(к).
В настоящем издании принимается значение энтальпии образования кристаллического соединения состава Mn3C, равное:
DfH°(Mn3C, к, 298.15 K) = ‑35 ± 10 кДж×моль‑1.
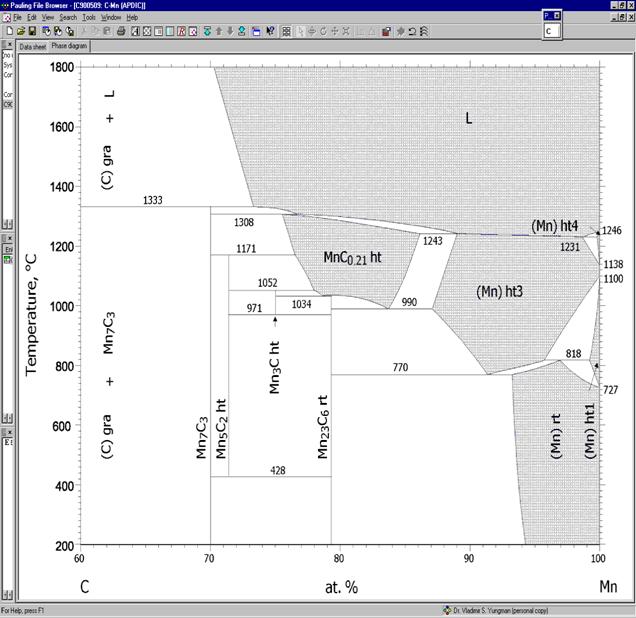
В электронном издании [2002VIL] представлено 11 диаграмм состояний системы Mn ‑ C. Последняя по времени публикации диаграмма состояний [90MAS2] приведена на рисунке 1. Эта диаграмма была подвергнута критическому анализу со стороны международной организации APDIC (Alloys Phase Diagram International Commission) и была признана наиболее надежной, т.е. имеющей квалификацию APDIC. Согласно этой диаграмме, система Mn ‑ C имеет 4 стехиометрические кристаллические фазы: Mn7C3(к), Mn5C2(к), Mn3C(к) и Mn23C6(к). Принятое в данном издании значение энтальпии образования соединения состава Mn3C(к) вычислено из температуры сосуществования трех кристаллических фаз: Mn5C2(к), Mn3C(к) и Mn23C6(к), которая, согласно диаграмме состояний [90MAS2], составляет 971°С. Таким образом, для равновесия:
5Mn5C2(к) + Mn23C6(к) = 16Mn3C(к) (1)
имеем: DrG°(971°С) = 0 , DrH°(реакция 1, 298.15 K) = +5 ± 141 кДж×моль‑1 и
DfH°(Mn3C, к, 298.15 K) = ‑35 ± 9 кДж×моль‑1.
Ряд диаграмм из числа представленных в [2002VIL] (без квалификации APDIC) содержат информацию о пятом соединении, близком по составу к Mn23C6(к). По-видимому, единственная более или менее достоверная информация по этому соединению состоит в идентификации типа решетки (гексагональная) и ее численных параметров. Хуже обстоит дело с химическим составом этого соединения; в литературе имеются обозначения: Mn7C2 (Mn3.5C), Mn11C3 (Mn3.67C), Mn15C4, (Mn3.75C). На диаграмме состояний [89LEE/LEE] это состояние обозначено как ?Mn4C, что, видимо, отражает лишь близость состава к составу Mn4C. В данном издании мы принимаем для этого соединения формулу Mn15C4 (по [73BEN/ELL]), что приводит к альтернативному способу вычисления энтальпии образования Mn3C: для равновесия:
3Mn5C2(к) + Mn15C4(к) = 10Mn3C(к) (2)
имеем: DrG°(971°С) = 0 , DrH°(реакция 2, 298.15 K) = +2 ± 88 кДж×моль‑1 и
DfH°(Mn3C, к, 298.15 K) = ‑37 ± 10 кДж×моль‑1.
Принятое значение соответствует величине, полученной из равновесия (1).
Принятому значению соответствует величина:
DfH°(Mn3С, к, 0 К) = -35.156 ± 10 кДж×моль‑1.
Константа равновесия реакции Mn3С(к) = 3Mn(г) + С(г) вычислена с использованием значения DrH°(0) = 1596.253 ± 11 кДж×моль‑1, соответствующего принятым энтальпиям образования.

Рис. 1. Диаграмма состояний системы Mn – C [90MAS2]
Авторы:
Аристова Н.М., Гусаров А.В. a-gusarov@yandex.ru
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
9.04.09
|
Таблица Mn.1. Принятые значения термодинамических величин для марганца и его соединений в кристаллическом и жидком состояниях.
Cp°(T)=a+bT-cT -2.+dT2 +eT3 (в Дж×K-1×моль-1) MnCl2: а d×106 = 97.947 MnS: а d×106 = -83.867; e·109 = 29.417
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [42SOU/MOO] | Southard J.C.,Moore G.E. -"High-temperature heat content of Mn3O4, MnSiO3 and Mn3C." J. Amer. Ceram. Soc.,1942,64,p. 1769-1770 |
| [43KEL/MOO] | Kelley K.K.,Moore G.E. -"Specific heats at low temperatures of manganese carbide and manganese dioxide." J. Amer. Chem. Soc.,1943,65,No.5,p.782-785 |
| [54KUO/PER] | Kuo K.,Persson L.E. -"A contribution to the constitution of the ternary system Fe-Mn-C." J. Iron and Steel Inst. (London),1954,178,No.part1,p.39-44 |
| [57PIC/FLA2] | Picon M.,Flahant J. - C. r. Acad. sci., 1957, 245, No.5, p.534-537 |
| [57PIC/FLA] | Picon M.,Flahant J. - C. r. Acad. sci., 1957, 245, No.1, p.62-64 |
| [73BEN/ELL] | Benz R.,Elliott J.F.,Chipman J. - "Solid Phases of the Mn-C System." Metallurgical Transactions,1973,4,p.1449- |
| [77БОЛ/ЛИТ] | Болгар А.С.,Литвиненко В.Ф.,Баран Т.А.,Домасевич Л.Т. -"Энтальпия и теплоемкость карбидов марганца." 7-ая всесоюзная конференция по калориметрии. Расширенные тезисы докладов. Черноголовка,1977,ч.2,с.350 |
| [89LEE/LEE] | Lee B.J.,Lee D.N. - "A Thermodynamic Study on the Mn-C and Fe-Mn Systems." Calphad,1989,13,p.345-354 |
| [90MAS2] | Massalski T.B. - 'ASM International,Materials Park.' Editor: Massalski T.B.,1990 |
| [95BAR] | Barin I. -'Thermochemical Data of Pure Substances.', Duisburg: 3-d edition,1995,p.1-2518 |
| [2002VIL] | Villars P. - "Pauling File Binaries Edition on CD-ROM."'Crystal Impact.' Editors:Villars P.,2002,1 |