Медь и её соединения
Хлорид меди
CuCl(к, ж). Термодинамические свойства кристаллического и жидкого
хлорида меди в стандартном состоянии при температурах 100 - 3000 K
приведены в табл. CuCl_c.
Значения постоянных, принятые для расчета термодинамических функций CuCl(к, ж),
приведены в табл. Cu.1. За стандартное состояние CuСl(к) в
интервале 0 – 685 К принята α‑кубическая модификация
(структурный тип ZnS, сфалерит), а в интервале 685 – 696
К - b‑гексагональная
модификация (структурный тип ZnS, вюртцит).
По-видимому, наиболее точные измерения теплоемкости хлорида меди при низких
температурах проведены в неопубликованной работе Стьюва (1981г.), результаты
которой известны нам по справочнику Панкратц [84PAN]; при
стандартной температуре: Cp°(298.15 K) = 52.55
Дж×K‑1×моль‑1
и S°(298.15
K) = 87.84
Дж×K‑1×моль‑1.
Эти данные приняты в настоящей работе. Измерения теплоемкости CuCl(к)
проведены также в работах Вардени и др. [76VAR/MOS] (5 - 155 K) и
Баррона и др. [77BAR/BIR] (1.3 - 16 K).
Расчет по этим данным, включая интерполяцию теплоемкости от 155 K до
298.15 K,
приводит к значению S°(298.15
K) = 88.3 Дж×K‑1×моль‑1,
которое согласуется с данными Стьюва с точностью 0.5%. По этому расчету
принимаются значения термодинамических функций CuCl(к) при
100 и 200 К, а также значение H°(298.15·K) - H°(0) = 11.4 кДж×моль‑1.
Погрешности принятых значений S°(298.15
K) и H°(298.15·K) - H°(0) (см. табл. Cu.1) оценены в
0.5 Дж×K‑1×моль‑1
и 0.1 кДж×моль‑1
соответственно.
При Т > 298.15 K
измерения энтальпии CuCl(к, ж) были проведены Карре и др.,. [69CAR/PHA] (677 - 849 K),
Томпсоном и Фленгасом [71THO/FLE] (491 - 917 K) и в
неопубликованной работе Ферранте [81FER], результаты которой известны
нам только по справочнику [84PAN]. Данные первых двух работ [69CAR/PHA, 71THO/FLE] не
точные, они имеют большой разброс и расходятся между собой в пределах 5%.
Данные Ферранте, судя по опубликованным измерениям энтальпии CuBr(к, ж)
[84FER/BRO] и CuI(к, ж)
[87FER/MRA],
имеют погрешности в пределах 0.5%. В настоящем справочнике для CuCl(к, ж)
принимаются данные Ферранте. В табл. Cu.1 по этим данным приводятся уравнения
для теплоемкости a-CuCl, b-CuCl и
жидкого CuCl, а также значения температур и энтальпий фазовых
переходов CuCl. (см. табл. Cu.1). Принятое нами значение энтальпии a"b-превращения CuCl (6.5
кДж×моль‑1)
отличается от величины, приведенной в справочнике Панкратц [84PAN] (4.9
кДж×моль‑1).
Это расхождение связано с тем, что в последнем для теплоемкости a-CuCl в
районе температуры превращения (685 К) приводится l-кривая с максимальным
значением 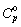 (685 K) = 246 Дж×K‑1×моль‑1.
Выведенное нами уравнение для Ср
приводит к значению
(685 K) = 246 Дж×K‑1×моль‑1.
Выведенное нами уравнение для Ср
приводит к значению 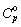 (685 K) = 65 Дж×K‑1×моль‑1.
Скрытая энтальпия предпревращения отнесена нами к энтальпии превращения. В
связи с тем, что уравнение для теплоемкости CuCl(ж),
которое хорошо описывает нисходящую ветвь l-кривой теплоемкости,
при высоких температурах (выше 1500 К) приводит к нереально высоким значениям Ср, нами в интервале 1200 – 3000 К
было предложено оценочное линейное уравнение, приводящее к медленному росту
теплоемкости в указанном интервале температур. При этом были учтены
экспериментальные данные по теплоемкости расплавов моногалогенидов меди и
серебра.
(685 K) = 65 Дж×K‑1×моль‑1.
Скрытая энтальпия предпревращения отнесена нами к энтальпии превращения. В
связи с тем, что уравнение для теплоемкости CuCl(ж),
которое хорошо описывает нисходящую ветвь l-кривой теплоемкости,
при высоких температурах (выше 1500 К) приводит к нереально высоким значениям Ср, нами в интервале 1200 – 3000 К
было предложено оценочное линейное уравнение, приводящее к медленному росту
теплоемкости в указанном интервале температур. При этом были учтены
экспериментальные данные по теплоемкости расплавов моногалогенидов меди и
серебра.
Измеренные недавно [2001ЗАХ/КЛЮ] температуры превращения и плавления CuCl
удовлетворительно согласуются с принятыми нами по данным [81FER].
Ссылки на другие, менее точные определения Тtr и Тm см. в
справочнике [72МЕД/БЕР].
Погрешности вычисленных значений Φ°(T) при температурах 298.15,
1000, 2000 и 3000 K оцениваются в 0.15, 2, 10 и 15 Дж×K‑1×моль‑1
соответственно. Термодинамические функции, приведенные в табл. CuCl_c
настоящего справочника и в справочниках [84PAN]
(298.15 - 1700 K) и [95BAR], практически совпадают, так
как основаны на одних и тех же экспериментальных данных.
Принятое значение энтальпии образования
DfH°(CuCl, к,
298.15K) = -137.0 ± 1.0 кДж×моль‑1
основано на данных, приведенных в табл. Cu.14.
Погрешность включает характеристику воспроизводимости измерений, неточность
термодинамических функций и погрешности использованных в расчетах
термохимических величин. Выбранное значение основано на результатах работ [18NOY/CHO, 28NIE/BRO, 30WAT, 36KAP, 70BUG/SHE, 74ВАС/КУН и 79СОС/ФОФ], имеющих минимальные априорные погрешности (не более 1.0
кДж×моль‑1)
и хорошо согласующихся друг с другом; принято среднее из отобранных значений.
Исследования равновесия Cu - CuCl приводят к близким значениям; наиболее
отклоняющееся значение было получено в [26PAR/MAL]
(-126.3 ± 4).
Исследования равновесия CuCl – CuCl2,
выполненные при температурах, превышающих эвтектическую температуру системы
(649-656 K [27BIL/FIS]), ненадежны из-за сложностей, связанных с
неединичностью активностей компонентов; результаты измерений [27BIL/FIS, 64HAM/GRE],
выполненных ниже этой температуры, с принятым значением согласуются.
Давление пара в реакции CuCl(к) = CuCl(г)
вычислено по значению DsH°(CuCl, к, 0) = 215.233 ± 7.4 кДж×моль‑1,
соответствующему принятым значениям энтальпий образования CuCl(к) и CuCl(г).
АВТОРЫ
Бергман Г.А. bergman@yandex.ru
Гусаров А.В. a-gusarov@yandex.ru
Версия для печати

