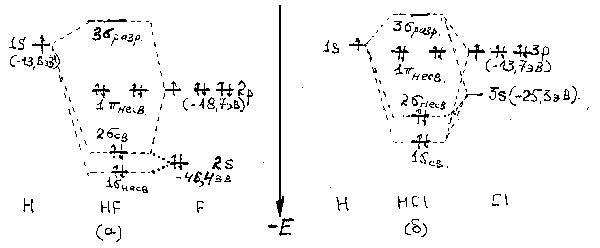
Рассмотрим особенности химической связи в молекулах галогеноводородов. На рис.4 изображена диаграмма энергетических уровней молекулярных орбиталей молекул HF и HC.
Рис.4.Схема молекулярных орбиталей HF (a), HCl (б).Ось z проходит через центры атомов водорода и галогена.
Разность энергий 1s-орбитали атома водорода
(-13.6 эВ) и 2s-орбитали атома фтора (-46.4 эВ) велика
(-13.6 эВ + 46.4 эВ = 32.8 эВ) (рис.1), поэтому 1![]() св - связывающая
молекулярная орбиталь формируется, в основном,
(~90%) 2s-орбиталями фтора. Энергия 1
св - связывающая
молекулярная орбиталь формируется, в основном,
(~90%) 2s-орбиталями фтора. Энергия 1![]() св -орбитали
оказывается самой низкой, и она играет важнейшую
роль в связывании атомов водорода и фтора. 1s-орбитали
атома водорода и 2pz-орбитали атома
фтора образуют 2
св -орбитали
оказывается самой низкой, и она играет важнейшую
роль в связывании атомов водорода и фтора. 1s-орбитали
атома водорода и 2pz-орбитали атома
фтора образуют 2![]() несв-
и 3
несв-
и 3![]() разр-молекулярные
орбитали. Основной вклад (~90%) в образование 1
разр-молекулярные
орбитали. Основной вклад (~90%) в образование 1![]() св - и 2
св - и 2![]() несв-орбиталей вносят
орбитали фтора. Это означает, что они в бу льшей
степени принадлежат фтору, чем водороду, а
электроны, расположенные на этих орбиталях,
практически локализованы на атоме фтора. Таким
образом, электронная плотность в молекуле HF
смещена к атому фтора, а связь H+
несв-орбиталей вносят
орбитали фтора. Это означает, что они в бу льшей
степени принадлежат фтору, чем водороду, а
электроны, расположенные на этих орбиталях,
практически локализованы на атоме фтора. Таким
образом, электронная плотность в молекуле HF
смещена к атому фтора, а связь H+![]() -F-
-F-![]() оказывается
полярной: атом фтора несет некоторый
отрицательный, а атом водорода - положительный
заряд.
оказывается
полярной: атом фтора несет некоторый
отрицательный, а атом водорода - положительный
заряд.
Распределение электронной плотности может быть рассчитано или определено экспериментально и представлено в виде сечения молекулы HF некоторой
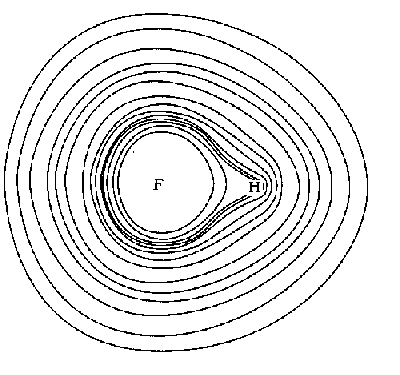
Рис.5. Контурная диаграмма распределения электронной плотности в молекуле HF.
плоскостью (рис.5). Точки с одинаковой электронной плотностью представлены линиями. Распределение электронной плотности не симметрично. Большая электронная плотность сосредоточена вблизи ядра фтора. Тем не менее, часть электронной плотности распределена между атомами фтора и водорода, и это соответствует ковалентной связи.
2px - и 2py -орбитали атома фтора
по условиям симметрии способны участвовать в
образовании ![]() -связей, но у
атома водорода доступных по энергии р-орбиталей
нет. Поэтому 1
-связей, но у
атома водорода доступных по энергии р-орбиталей
нет. Поэтому 1![]() -орбитали (рис.4а)
остаются несвязывающими. Два из восьми
электронов (один от атома водорода, семь от атома
фтора) размещаются на 1
-орбитали (рис.4а)
остаются несвязывающими. Два из восьми
электронов (один от атома водорода, семь от атома
фтора) размещаются на 1![]() св-орбитали
и обуславливают связь между атомами водорода и
фтора. Оставшиеся шесть электронов занимают 2
св-орбитали
и обуславливают связь между атомами водорода и
фтора. Оставшиеся шесть электронов занимают 2![]() несв- и 1
несв- и 1![]() несв-орбитали.
Они ослабляют связь водорода со фтором, так как
принимают участие в межэлектронном
отталкивании. Таким образом, электронная
конфигурация молекулы НF запишется в виде
несв-орбитали.
Они ослабляют связь водорода со фтором, так как
принимают участие в межэлектронном
отталкивании. Таким образом, электронная
конфигурация молекулы НF запишется в виде ![]() .
.
Диаграмма молекулярных орбиталей при переходе
от HF к HCl несколько изменяется, что связано с
изменением энергии и размеров атомных орбиталей
галогена. Энергии 3s- и 3р-орбиталей атома хлора
увеличиваются и приближаются (особенно энергия
3р-орбиталей) к энергии 1s-орбитали атома водорода.
Уменьшается и разность энергий 3s- и 3р-орбиталей.
Все это приводит к тому, что в образовании
молекулярных орбиталей HCl участвуют как
1s-орбитали водорода, так и обе 3s- и 3р-орбитали
атома хлора. Взаимодействие (перекрывание) 1s-, 3s- и
3р-атомных орбиталей приводит к образованию 1![]() связ-, 2
связ-, 2![]() несв-
и 3
несв-
и 3![]() разр-молекулярных
орбиталей, причем 2
разр-молекулярных
орбиталей, причем 2![]() несв-орбиталь
по энергии оказывается близкой к энергии
3s-орбитали хлора и носит, в основном,
несвязывающий характер. Как и в молекуле HF, 1
несв-орбиталь
по энергии оказывается близкой к энергии
3s-орбитали хлора и носит, в основном,
несвязывающий характер. Как и в молекуле HF, 1![]() -орбиталь остается несвязывающей.
Участие 1s-орбитали атома водорода в образовании 1
-орбиталь остается несвязывающей.
Участие 1s-орбитали атома водорода в образовании 1![]() связ-орбитали уменьшает
смещение электронной плотности к атому хлора и
тем самым понижает полярность молекулы HCl по
сравнению с HF.
связ-орбитали уменьшает
смещение электронной плотности к атому хлора и
тем самым понижает полярность молекулы HCl по
сравнению с HF.
В целом, по мере увеличения энергии ns- и np-орбиталей, уменьшения их разности, а также увеличения размера атома галогена в ряду HF-HCl-HBr-HI энергия молекулярных орбиталей увеличивается, а локализация электронов на орбиталях атома галогена и полярность молекул HХ уменьшаются.
5.1 Физические свойства галогеноводородов.
Рассмотрим физические свойства галогеноводородов, используя данные табл.4. По мере увеличения размера атомов галогенов межатомное расстояние Н-Х увеличивается, энергия связи Н- Х уменьшается. Уменьшение энергии связи Н-Х приводит к повышению значений энтальпий образования в ряду HF-HI, например, HI в стандартных условиях образуется из простых веществ уже с поглощением тепла (табл.4).
Таблица 4. Свойства галогеноводородов.
Межатомное |
Есвязи |
|
Дипольный момент, D |
рКа |
Тпл,оС |
Ткип,оС |
|
HF |
0.92 |
565 |
-271 |
1.91 |
3.2 |
-83.4 |
+19.7 |
HCl |
1.28 |
431 |
-92 |
1.03 |
-7.0 |
-114.3 |
-85.1 |
HBr |
1.41 |
364 |
-36 |
0.79 |
-9.5 |
-86.9 |
-66.8 |
HI |
1.60 |
297 |
+27 |
0.42 |
-10 |
-50.9 |
-35.4 |
Молекулы HХ полярны. Полярность количественно характеризуется величиной дипольного момента. Дипольные моменты убывают в ряду HF-HI. С точки зрения МО ЛКАО полярность определяется различием энергий взаимодействующих 1s-атомной орбитали водорода и ns-, np-орбиталей атома галогена. Как отмечалось, в ряду F-Cl-Br-I эта разница, а также степень локализации электронов на атомах галогена и полярность молекул НХ уменьшаются.
В стандартных условиях галогеноводороды - газы. С ростом массы и размеров молекул усиливается межмолекулярное взаимодействие и, как следствие, повышаются температуры плавления (Тпл) и кипения (Ткип). Однако для HF величины Тпл и Ткип, полученные экстраполяцией в ряду однотипных соединений HF-HCl-HBr-HI, оказываются существенно ниже, чем экспериментальные (табл.4). Аномально высокие температуры плавления и кипения объясняются усилением межмолекулярного взаимодействия за счет образования водородных связей между молекулами HF:
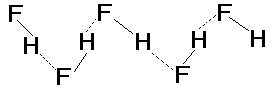
Твердый HF состоит из зигзагообразных полимерных цепей. В жидком и газообразном HF вплоть до 60оС присутствуют полимеры от (HF)2 до (HF)6. Для HCl, HBr, HI образование водородных связей не характерно из-за меньшей электроотрицательности атома галогена.
5.2. Химические свойства галогеноводородов.
Растворимость в воде. Благодаря высокой
полярности газообразные НХ хорошо
растворимы в воде * ) , например, в 1 объеме
воды при 0оС растворяется 507 объемов HCl или
612 объемов HBr. При охлаждении из водных
растворов выделены кристаллические гидраты HF.
H2O, HCl. 2H2O и т.д., которые
построены из соответствующих галогенидов
оксония, например, ![]() .
.
Кислотные свойства. В водных растворах НХ устанавливается протолитическое равновесие
HX + HOH = ![]() + H3O+
(X = F, Cl, Br, I), (1),
+ H3O+
(X = F, Cl, Br, I), (1),
то есть эти растворы являются кислотами.
В ряду HCl-HBr-HI степень протолиза, то есть сила
кислот увеличивается (см.величины рКa в
табл.4), что связано с ростом размера аниона ![]() и уменьшением энергии
гетеролитического распада НХ(р-р)= Н+(р-р)
+
и уменьшением энергии
гетеролитического распада НХ(р-р)= Н+(р-р)
+ ![]() (р-р)
([1], с.291).
(р-р)
([1], с.291).
Водные растворы HCl, HBr и HI ведут себя как
сильные кислоты. В разбавленных водных растворах
HF является слабой кислотой (рКа = 3.2),
что связано с высокой энергией связи H-F по
сравнению с энергией связи H-О в молекуле
воды. Однако при повышении концентрации HF
выше 1 М сила кислоты увеличивается. За счет
образования водородной связи образуются ионы ![]() : HF +
: HF + ![]() =
=![]() ; К = 3.86 (25оС)
и поэтому равновесие (1) смещается вправо.
; К = 3.86 (25оС)
и поэтому равновесие (1) смещается вправо.
Особенностью фтороводорода и плавиковой кислоты является способность разъедать стекло:
Na2O. CaO. 6SiO2 + 28HF(газ) = 2NaF + СaF2 + 6SiF4 + 14H2O
Na2O. CaO. 6SiO2 + 36HF(р-р) = Na2SiF6 + CaSiF6 + 4H2SiF6 + 14H2O,
поэтому при работе с ними пользуются посудой, сделанной из тефлона.
Восстановительные свойства галогеноводородов. С увеличением размера и уменьшением энергии ионизации атома галогена восстановительная способность в ряду HF-HCl-HBr-HI увеличивается (табл.5). Например, плавиковая HF и соляная HCl кислоты с концентрированной серной кислотой не взаимодействуют, а HBr и HI ею окисляются:
2HBr + H2SO4(конц) = Br2 + SO2 + 2H2O
8HI + H2SO4(конц) = 4I2 + H2S + 4H2O.
Таблица 5.Стандартные потенциалы (Ео,
В) реакции ![]() .
.
F |
Cl |
Br |
I |
+2.82 |
+1.36 |
+1.06 |
+0.53 |