|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[предыдущий раздел] [содержание] [следующий
раздел]
§ 14. Галогениды халькогенов.
Среди различных классов соединений
халькогенов их галогениды наиболее
многочисленны и разнообразны. Синтезированы и
выделены галогенидные соединения, содержащие
атомы халькогенов в различных степенях
окисления - от низших (SnCl2 и SnBr2
(n = 3-8), Te3Cl2, S2X2 и Se2X2
(X = F, Cl, Br), TeI) до высших (ЭF6). Прочность
химических связей сера-галоген (табл.10)
понижается от F к I, благодаря чему, например,
не образуются бинарные иодиды серы и селена:
Таблица 10.Энергия связи
сера-галоген.
Связь
Энергия, кДж/моль |
S-F
327 |
S-Cl
271 |
S-Br
218 |
S-I
~170 |
Галогениды халькогенов преимущественно
синтезируют взаимодействием простых веществ,
либо восстановлением высших галогенидов
свободными халькогенами: SeX4 + Se Se2X2. Se2X2.
Фториды во многом отличаются от других
галогенидов по устойчивости, химической
активности и составу. Соединения FSSF
(1,2-дифтородисульфид) и SSF2
(1,1-дифтородисульфид или тионилфторид) и
аналогичные S2Cl2 и Se2F2 представляют
редкие в неорганической химии примеры
структурной изомерии F-S-S-F и 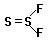 . В воде они быстро гидролизуются с
выделением S8, HХ и смеси политионовых
кислот, например, . В воде они быстро гидролизуются с
выделением S8, HХ и смеси политионовых
кислот, например,
5SSF2 + 6H2O  3/4 S8 + H2S4O6 + 10HF. 3/4 S8 + H2S4O6 + 10HF.
S2Cl2 широко используется в качестве
вулканизатора резины и хлорирующего реагента
при вскрытии некоторых минералов.
Дигалогениды ЭХ2 можно получить
галогенированием молекул Э2X2:
S2Cl2 + Cl2  2SCl2. 2SCl2.
ЭХ2 характеризуются низкими
температурами кипения. Молекулы ЭХ2 имеют
угловую форму. Устойчивость дигалогенидов
возрастает к Ро.
Наиболее многочисленны тетрагалогениды,
которые синтезируют различными путями: Э + Х2,
ЭО2 + Х2, CCl4 + ЭО2 и т.д.
Структуры газообразных молекул SF4 и SeF4
описываются по методу отталкивания валентных
электронных пар и представляют собой
тригональную бипирамиду с экваториальной
позицией, занятой неподеленной электронной
парой. Благодаря этому структура сильно
искажается: экваториальный угол между связями F-
S- F уменьшается от идеального 120о до 103о
и аксиальные атомы Fакс отталкиваются к
атомам Fэкв.. При этом идеальный угол Fакс-S-Fакс
180о уменьшается до 179о, а длина
связей S- Fакс и S- Fэкв оказывается
разной (рис.11а). Влияние неподеленной электронной
пары у SeF4 еще более сильное: угол Fакс- Sе-
Fакс уменьшается до 169.2о. Тетрахлорид
серы SCl4 весьма неустойчив и распадается
выше -20оС. Для твердых галогенидов SeX4
и TeX4 характерно образование тетрамеров.
Тетрагалогениды полония имеют солеобразный
характер. Тетрагалогениды S, Se, Te и Po, будучи
кислотными соединениями, сравнительно легко
гидролизуются с образованием соответствующих
кислот: SeCl4 + 3H2O  H2SeO3 + 4HCl и взаимодействуют
с галогенидами металлов: TeF4 + KF H2SeO3 + 4HCl и взаимодействуют
с галогенидами металлов: TeF4 + KF  K[TeF5] (рис.11б) и TeF4
+ 2KF K[TeF5] (рис.11б) и TeF4
+ 2KF  K2[TeF6].
Образование комплексных галогенидов
свойственно также и полонию: PoCl4 + 2KCl K2[TeF6].
Образование комплексных галогенидов
свойственно также и полонию: PoCl4 + 2KCl   K2[PoCl6] (рис.11в). K2[PoCl6] (рис.11в).
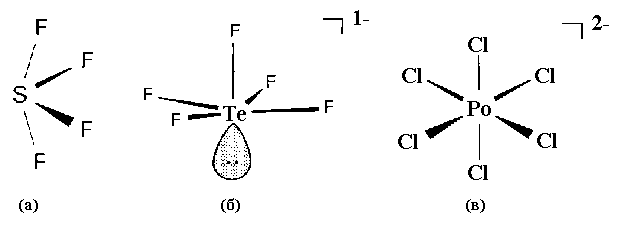
Рис.11. Пространственное строение
молекул и ионов галогенидов халькогенов:
SF4 (а), TeF5-(б), PoCl62-
(в).
Геометрическая форма комплексных ионов [SeCl6]2-
и [TeF6]2- соответствует правильному
октаэдру, а иона [TeF5]- - пирамиде, поскольку
одна из вершин октаэдра занята неподеленной
электронной парой Te (IV).
Из галогенидов халькогенов в высшей степени
окисления получены гексафториды SF6, SeF6
и TeF6. Среди всех галогенидов SF6
выделяется устойчивостью и химической
инертностью. Газообразный при комнатной
температуре SF6 не имеет запаха и вкуса,
не горит, выдерживает нагревание до 500оС
без разложения, не взаимодействует с
большинством металлов и неметаллов даже при
нагревании. По отношению к воде SеF6 напоминает
SF6, но разлагается водными растворами KI и Na2S2O3.
TeF6 в течение суток гидролизуется
полностью.
Относительная устойчивость SF6 по
сравнению с SF4, обусловлена кинетическими
факторами. Шесть атомов фтора стерически
экранируют атом серы и мешают приближению
возможных атакующих групп. Термодинамически же
гидролиз SF6: SF6(газ) + 3 H2O(газ)
 SO3(газ) + 6HF(газ)
возможен, поскольку изменение энергии Гиббса
этого процесса составляет SO3(газ) + 6HF(газ)
возможен, поскольку изменение энергии Гиббса
этого процесса составляет  Gо = - 301.2 кДж/моль. В связи с
инертностью и исключительными диэлектрическими
свойствами SF6 широко используется в
качестве газообразного изолятора в
высоковольтных аппаратах. Gо = - 301.2 кДж/моль. В связи с
инертностью и исключительными диэлектрическими
свойствами SF6 широко используется в
качестве газообразного изолятора в
высоковольтных аппаратах.
Помимо описанных, синтезированы низшие
галогениды SnX2 (X = Cl, Br, n =3-8).
Благодаря меньшей электроотрицательности Cl и Br
по сравнению с F и меньшей энергии связей S-Cl и S-Br
по отношению к S-F в низших хлоридах и бромидах
проявляется способность серы к катенации. С
помощью реакций типа: H2Sn + 2S2Cl2
= S4+nCl2 + 2HCl, 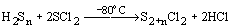 выделены индивидуальные соединения SnCl2
и SnBr2 (n = 3-8). В смесях существуют дихлоросульфаны
до S100Cl2, при этом олигомеры-Sn-
стабилизируются образованием концевых связей
S-Cl..
выделены индивидуальные соединения SnCl2
и SnBr2 (n = 3-8). В смесях существуют дихлоросульфаны
до S100Cl2, при этом олигомеры-Sn-
стабилизируются образованием концевых связей
S-Cl..
У Te существует несколько субгалогенидов,
полученных по реакциям Te + X2 и
характеризующихся наличием зигзагообразных
гомоатомных цепей из атомов Te. Эти цепи во многом
аналогичны цепям в свободном теллуре.
[предыдущий раздел] [содержание] [следующий
раздел]
|

