Переход фазовый (ф.п.) – термодинамический процесс перехода вещества из одной фазы в другую;
первого рода – фазовый переход, при котором претерпевают скачки первые производные от химического потенциала (S и V);
второго рода – фазовый переход, при
котором первые производные от химического
потенциала непрерывны, но претерпевают скачки
его вторые производные (cP, ![]() ,
, ![]() T);
T);
монотропный – односторонний ф.п., при котором переход от высокотемпературной модификации к низкотемпературной невозможен, тогда как обратный процесс осуществляется и протекает тем быстрее, чем выше температура;
энантиотропный – взаимные превращения двух кристаллических модификаций, которые могут самопроизвольно протекать как в прямом так и в обратном направлениях в зависимости от условий.
Правило фаз Гиббса – в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только 2 фактора - температура и давление (соответствуют слагаемому "2" в ур-нии), число степеней свободы (C) равно числу независимых компонентов (K) минус число фаз (Ф) плюс два: С = К - Ф + 2. Если Ф = 0, система инвариантна, Ф = 1 - моновариантна, Ф = 2- бивариантна и т.д.
Уравнение Клапейрона-Клаузиуса для
фазовых превращений ![]()
равновесие "кристалл" ![]() жидкость":
жидкость": ![]()
равновесие "жидкость"![]() пар":
пар": ![]() ,
,
если насыщенный пар подчиняется ур-нию состояния идеального газа , то
при испарении ![]() ;
;![]() , при возгонке
, при возгонке ![]() ;
;![]() .
.
В интегральном виде 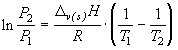
Подвижность иона
абсолютная u+(-) [м2. с-1. В-1] – скорость движения иона при напряженности электрического поля 1 В. м-1;
предельная ![]() [Ом-1.
см2. г-экв-1] – подвижность
иона при бесконечном разбавлении
[Ом-1.
см2. г-экв-1] – подвижность
иона при бесконечном разбавлении ![]() = u+(-)F. Предельную
подвижность иона с зарядом z и радиусом r в
растворителе с вязкостью h о принято
выражать формулой Стокса (e – элементарный
заряд):
= u+(-)F. Предельную
подвижность иона с зарядом z и радиусом r в
растворителе с вязкостью h о принято
выражать формулой Стокса (e – элементарный
заряд):
![]() =
=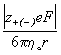
Полиморфизм
– способность твердых в-в и жидких кристаллов существовать в нескольких формах с различной кристаллической структурой и свойствами (см. также переход фазовый).Порядок реакции
порядок реакции по веществу (a, b, c) – показатель степени при концентрации этого реагента (A, B, C) в кинетическом уравнении реакции w = k. [A]a[B]b[C]c.
порядок реакции общий (n = a + b + c) – сумма показателей степеней при концентрациях реагентов в кинетическом уравнении реакции w = k. [A]a[B]b[C]c. Может быть положительным или отрицательным, целым или дробным, нулевым. Определяется механизмом реакции, зависит от концентрации реагирующих веществ, присутствия катализатора и часто от температуры.
Потенциал
[В, мВ] – работа по переносу единичного пробного заряда из точки "электродный – потенциал электрода,
измеренный относительно стандартного
водородного электрода, т.е. ЭДС цепи Me![]() Pt, H2(газ,
1 атм)
Pt, H2(газ,
1 атм)![]() H+(a=1)
H+(a=1)![]()
![]() Mez+
Mez+ ![]() Me.
Определяется суммой скачков потенциалов на
границах Me
Me.
Определяется суммой скачков потенциалов на
границах Me![]() Pt, H2
Pt, H2 ![]() H+ и Mez+
H+ и Mez+![]() Me,
рассчитывается по формуле Нернста:
Me,
рассчитывается по формуле Нернста:
![]()
Если активности окисленной (aок) и восстановленной (авосст) форм равны 1, то ЭДС такой цепи равна стандартному электродному потенциалу Ео. Стандартный потенциал - величина, характерная для данного электродного процесса, зависит от температуры и природы участников процесса.
Потенциал термодинамический
[Дж. моль-1] – характеристическая функция, убыль которой в равновесном процессе, протекающем при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе. Прим.: U, H, F, G.Потенциал химический – частная производная характеристической функции по массе компонента при постоянных соответствующих независимых переменных и массах остальных компонентов; при P,T = const - парциальная энергия Гиббса.
![]() i =
i =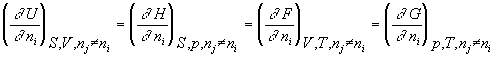 .
.
Уравнение Гиббса-Дюгема:
при P,T = const, ![]() или для 2-х компонентной системы
или для 2-х компонентной системы ![]() .
.
Химический потенциал i-го компонента раствора:
![]() i =
i = ![]() io(m)
+ RTlnai(m)=
io(m)
+ RTlnai(m)= ![]() io(c)+RTlnai(c)
=
io(c)+RTlnai(c)
= ![]() io(x) + RTlnai(x),
io(x) + RTlnai(x),
где ![]() io - абсолютное
значение химического потенциала вещества,
находящегося в состоянии, выбранном за стандартное
(система отсчета).
io - абсолютное
значение химического потенциала вещества,
находящегося в состоянии, выбранном за стандартное
(система отсчета).
Правило
Ле-Шателье – если на систему, находящуюся в состоянии устойчивого или метастабильного равновесия, оказывать воздействие извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, протекание которого ослабляет влияние произведенного воздействия.
Льюиса-Рендалла (см. активность
электролитов)
Вант-Гоффа (см. температурная зависимость
скорости реакции)
Трутона (см. энтропия)
фаз Гиббса (см. переход фазовый)
Юм-Розери (см. растворы)
Процесс термодинамический (т.п.)
– изменение состояния термодинамической системы, характеризующееся изменением ее параметров.Для идеального газа:
Тип процесса |
Характеристика |
Работа |
Теплота |
| изотермический | Т = const, |
Q = A,
|
|
| изобарный | Р = const | QP = |
|
| изохорный | V = const | A = 0 | QV = |
| адиабатный | Q = 0
|
A = - =
|
Q = 0 |
Работа А [Дж, кал]
– форма передачи энергии от одного тела к другому, не связанная с переносом теплоты и (или) вещества. Формулы для расчета работы расширения идеального газа см. процесс термодинамический.Для неидеального газа:
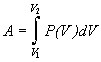 , в аналитическом
виде P(V) в равновесном процессе находят с
помощью ур-ния состояния газа.
, в аналитическом
виде P(V) в равновесном процессе находят с
помощью ур-ния состояния газа.
Равновесие
(см. также константа равновесия)Равновесное состояние – состояние системы, характеризующиеся при постоянных внешних условиях неизменностью термодинамических переменных во времени и отсутствием в системе потоков.
Равновесное состояние устойчивое (стабильное) – состояние системы, при котором всякое бесконечно малое воздействие вызывает только бесконечно малое изменение состояния, а при устранении этого воздействия система возвращается в исходное состояние.
Равновесное состояние метастабильное – состояние системы, при котором всякое бесконечно малое воздействие вызывает только бесконечно малое изменение состояния, а некоторые малые конечные воздействия - конечные изменения состояния, которые не исчезают при устранении этих воздействий.
Равновесное состояние неустойчивое (лабильное, нестабильное) – состояние системы, при котором всякое бесконечно малое воздействие вызывает конечное изменение состояния. Для термодинамических систем неустойчивость равновесия означает его отсутствие, так как малые изменения их состояния происходят в природе самопроизвольно из-за флуктуаций физических величин и сохранить равновесие в этом случае невозможно.
Равновесие фазовое – равновесное состояние термодинамической системы, состоящей из двух или большего числа фаз.
Равновесие химическое – термодинамическое равновесие, устанавливающееся в химически реагирующей системе.
Раствор –
гомогенная смесь переменного состава. Различают газообразные, жидкие и твердые растворы (т.р.). Т.Р. делятся на растворы замещения (1), внедрения (2) и вычитания (3). Образование (1) возможно, если оба компонента близки по кристаллохимическим свойствам и размеры частиц отличаются не более чем на 15% (правило Юм-Розери), тогда атомы, ионы или молекулы одного в-ва замещают в узлах кристаллической решетки частицы другого в-ва. При этом не меняется тип решетки и число атомов (ионов) в кристаллической ячейке (Z), но изменяются ее объем (V) и плотность (Азеотроп (гр., нераздельно кипящий) – раствор, у которого при определенных давлениях и температурах равновесно сосуществующие пар и жидкость имеют одинаковый состав.
Раствор идеальный (и.р.) – раствор, активности компонентов которого тождественно равны их мольным долям во всем интервале концентраций, и производные от активностей по давлению и температуре при постоянных концентрациях равны нулю. Для и.р. во всей области концентраций выполняется закон Рауля.
Для предельно разбавленных растворов:
понижение температуры замерзания ![]() ,
, ![]() - криоскопическая постоянная
- криоскопическая постоянная
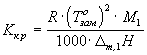 ,
, ![]() ,
,
где ![]() температура
замерзания чистого растворителя,
температура
замерзания чистого растворителя, ![]() - молярная теплота плавления чистого
растворителя,
- молярная теплота плавления чистого
растворителя, ![]() -
молекулярная масса растворителя,
-
молекулярная масса растворителя, ![]() - молекулярная масса растворённого
вещества,
- молекулярная масса растворённого
вещества, ![]() - масса
растворённого вещества,
- масса
растворённого вещества, ![]() - масса растворителя;
- масса растворителя;
повышение температуры кипения ![]() ,
, ![]() -
эбулиоскопическая постоянная:
-
эбулиоскопическая постоянная:
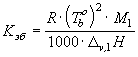 ,
, ![]() ,
,
![]() температура кипения
чистого растворителя, К,
температура кипения
чистого растворителя, К, ![]() - молярная теплота испарения чистого
растворителя;
- молярная теплота испарения чистого
растворителя;
осмотическое давление: ![]()
![]() =-RTlna1 (
=-RTlna1 (![]() - парциальный мольный
объем растворителя); для разбавленных растворов
- парциальный мольный
объем растворителя); для разбавленных растворов ![]() = cRT. Для веществ,
диссоциирующих при растворении см. изотонический
коэффициент.
= cRT. Для веществ,
диссоциирующих при растворении см. изотонический
коэффициент.
Осмотическое давление, изменение температур кипения и замерзания растворов и некоторые другие свойства разбавленных растворов, зависящие только от количества частиц, но не от природы растворенных веществ, называют коллигативными свойствами.
Растворимость [концентр.]
– равновесная концентрация вещества в растворе.Зависимость растворимости газа в жидкости от:
температуры ![]() (где
(где ![]() - изменение энтальпии в
процессе перехода моля газа из газообразного
состояния в состояние насыщенного раствора - т.н.
последняя теплота растворения): при низких
температурах
- изменение энтальпии в
процессе перехода моля газа из газообразного
состояния в состояние насыщенного раствора - т.н.
последняя теплота растворения): при низких
температурах ![]() и
и ![]() - растворимость газа
уменьшается с ростом температуры, при высоких T:
- растворимость газа
уменьшается с ростом температуры, при высоких T:
![]() - и растворимость
растет, при
- и растворимость
растет, при ![]() она
минимальна и растворимость увеличивается с
температурой;
она
минимальна и растворимость увеличивается с
температурой;
давления выражается ур-ем Генри ![]()
Зависимость растворимости твердых тел в жидкости от:
температуры ![]() ,
,
для идеального раствора ![]() и
и ![]() (ур-ние
Шредера) и растворимость увеличивается с
температурой; при небольших значениях P
растворимость практически не зависит от давления,
при увеличении P - для подавляющего
большинства веществ - уменьшается.
(ур-ние
Шредера) и растворимость увеличивается с
температурой; при небольших значениях P
растворимость практически не зависит от давления,
при увеличении P - для подавляющего
большинства веществ - уменьшается.
Некоторые физико-химические методы определения:
а) по данным об электропроводности насыщенного р-ра слабого электролита (полагают, что соль полностью диссоциирована, а подвижности ионов равны подвижностям при бесконечном разведении):
![]() ;
;
б) через произведение растворимости L и средний
ионный коэффициент активности ![]()
![]() :
:
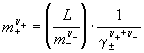 .
.
Прим.: определение растворимости хлорида серебра в присутствии соли, имеющей (1) и не имеющей общего иона (1) с AgCl;
(1) добавлен m-моляльный водный раствор KCl, средний
ионный коэффициент активности которого равен ![]()
![]() :
:
![]() ,
,
(2) добавлен m-моляльный водный раствор K2SO4:
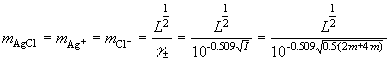 .
.