Газ идеальный – газ, подчиняющийся уравнению
состояния ![]() (V*-
мольный объем). Молекулы такого гипотетического
газа можно рассматривать как систему не имеющих
размеров материальных точек, которые не
взаимодействуют между собой, но оказывают
давление на стенки сосуда, в котором газ
находится. Внутренняя энергия и энтальпия
идеального газа зависят только от температуры.
(V*-
мольный объем). Молекулы такого гипотетического
газа можно рассматривать как систему не имеющих
размеров материальных точек, которые не
взаимодействуют между собой, но оказывают
давление на стенки сосуда, в котором газ
находится. Внутренняя энергия и энтальпия
идеального газа зависят только от температуры.
Гальванический элемент
(химический источник тока) (г.э.) – устройство, которое позволяет превращать энергию химической реакции в электрическую работу. По принципу работы различают первичные (разовые), вторичные (аккумуляторы) и топливные элементы. Г.э. состоит из ионпроводящего электролита и двух разнородных электродов (полуэлементов), процессы окисления и восстановления в г.э. пространственно разделены. Положительный полюс г.э. наз. анодом, отрицательный - катодом. Электроны выходят из элемента через анод и движутся во внешней цепи к катоду.Правила записи: слева располагается электрод, имеющий более отрицательный потенциал (анод), справа - катод; растворы отделяются вертикальной пунктирной линией, если они контактируют друг с другом, и двумя вертикальными линиями, если между ними находится солевой мостик; одна вертикальная линия означает границу раздела фаз, вертикальная пунктирная линия - мембрана. Прим.:
(Cu) Zn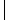 ZnSO4
ZnSO4 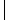
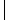 CuSO4
CuSO4 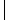 Cu (Cu), (Pt) Pt, H2
Cu (Cu), (Pt) Pt, H2 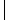 HCl
HCl![]() CuCl2
CuCl2 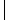 Cu (Pt)
Cu (Pt)
(в скобках записаны материалы токоотводов)
Давление P
(Па, бар, атм, мм рт.ст.) – скалярная величина, характеризующая напряженное состояние сплошной среды. В термодинамике под давлением подразумевают термодинамическую переменную, определяющую элементарную работуДавление насыщенного пара раствора – давление пара, находящегося в равновесии с раствором при данных температуре и составе.
Парциальное давление газа Pi –
давление, которое имел бы газ, находящийся в
газовой смеси, если бы он занимал объем, равный
объему смеси при той же температуре: ![]() (закон Дальтона).
(закон Дальтона).
Для предельно разбавленных растворов выполняется закон Генри:
Pi = KГxi (KГ - константа Генри).
Для идеальных растворов выполняется закон Рауля:
![]() ,
,
где ![]() - парциальное
давление i-го компонента в газовой фазе,
- парциальное
давление i-го компонента в газовой фазе, ![]() - давление насыщенного
пара чистого i-го компонента.
- давление насыщенного
пара чистого i-го компонента.
Для неидеальных растворов:
![]() ,
,
где yi - мольная доля i-го компонента в паре, PS - общее давление пара
Диаграмма
фазовая – графическое изображение всех возможных фазовых состояний системы в пространстве независимых термодинамических переменных.
Кривая фазового равновесия – кривая на фазовой диаграмме, соответствующая состояниям равновесно сосуществующих фаз. Кривая плавления (ликвидуса) соответствует равновесному сосуществованию твердой и жидкой фазы (см. также ур-ние Шредера). Линия, изображающая температуры конца кристаллизации, называется линией солидуса. Процессы, в ходе которых одна фаза растворяется (распадается), а другая выделяется, называются инконгруэнтными в отличие от конгруэнтных, при которых обе фазы одновременно или выделяются или растворяются. В частности, плавление химического соединения называется конгруэнтным, если состав образующейся жидкости тождественен с составом твердой фазы, и инконгруэнтным, если это условие не выполнено.
Коннода (нода) – отрезок на фазовой диаграмме, соединяющий две точки, соответствующие равновесным при данных условиях фазам.
Точка фигуративная – точка на фазовой диаграмме, изображающая состояние системы. Критическая точка соответствует критическому состоянию в-ва, т.е. такому состоянию, при котором исчезает различие между равновесно сосуществующими фазами. Тройная точка соответствует состоянию, в котором находятся в равновесии три фазы индивидуального вещества (напр., лед, вода и пар - при 0.0098o С, 4.6 мм рт. ст.). Эвтектическая точка – точка на диаграмме состояний, изображающая состав и состояние (Т и Р, если оно переменно) жидкой эвтектики, находящейся в равновесии с твердыми фазами. Эвтектика жидкая – раствор, который может при данном давлении находиться в равновесии с твердыми фазами, число которых равно числу компонентов системы, твердая – продукт затвердевания жидкой эвтектики. Перитектикой вообще называется жидкий раствор, который может при данных P,T находиться в инконгруэнтном равновесии с твердыми фазами, число которых равно числу компонентов системы, причем при отнятии теплоты от системы некоторые фазы будут растворяться, а другие - выделяться.
Закон
Закон действующих масс (в кинетике - см. скорость реакции, в термодинамике - см. константа химического равновесия).
Первый закон термодинамики – закон сохранения энергии; устанавливает взаимосвязь между теплотой и работой в различных процессах. Вводятся функции состояния системы - внутренняя энергия U и энтальпия H.
Q = ![]() U + A,
U + A,
или для бесконечно малых элементарных
процессов ![]() Q = dU +
Q = dU + ![]() A.
A.
Если единственной работой в системе является работа
расширения, то ![]() A = PвнешнdV,
в равновесном процессе Pвнешн =Pвнутр(V,T).
Изменение внутренней энергии
A = PвнешнdV,
в равновесном процессе Pвнешн =Pвнутр(V,T).
Изменение внутренней энергии ![]() U определяется начальным и
конечным состоянием системы и не зависит от пути
процесса.
U определяется начальным и
конечным состоянием системы и не зависит от пути
процесса.
Q>0, если она подводится к системе
(поглощается системой), Q ![]() 0, если система выделяет
теплоту: A>0, если она совершается системой.
(Согласно рекомендациям ИЮПАК работа,
совершаемая системой, имеет отрицательный знак.
В данном учебном пособии принята система знаков,
используемая в большинстве учебников)
0, если система выделяет
теплоту: A>0, если она совершается системой.
(Согласно рекомендациям ИЮПАК работа,
совершаемая системой, имеет отрицательный знак.
В данном учебном пособии принята система знаков,
используемая в большинстве учебников)
Второй закон термодинамики– закон о возможности протекания самопроизвольных процессов.
Для изолированной системы:
![]() ;
; ![]() (знак = в обратимых процессах, > в
необратимых);
(знак = в обратимых процессах, > в
необратимых);
TdS ![]() dU + PdV -
dU + PdV - ![]() Xidxi ,
xi - обобщенная координата, а Xi -
обобщенная сила.
Xidxi ,
xi - обобщенная координата, а Xi -
обобщенная сила.
Для закрытой системы:
A > 0, что равносильно условиям (![]() G)P,T < 0
или (
G)P,T < 0
или (![]() F)VT < 0.
F)VT < 0.
Третий закон термодинамики – закон об
абсолютном значении энтропии S. Для
идеального кристаллического тела при Т![]() 0 K S
0 K S![]() 0.
0.
Закон Генри (см. давление парциальное)
Закон Гесса (см. теплота реакции)
Закон Дальтона (см. давление парциальное)
Закон Кольрауша (см. эквивалентная
электропроводность)
Закон разведения Оствальда (см. степень
диссоциации)
Закон Рауля (см. давление парциальное)
Ионная сила I
[моль/кг] – полусумма произведений концентрации каждого иона на квадрат его заряда. Для 1,1-электролитов I = m, в общем случае:![]() .
.