Список условных обозначений
Латинский алфавит
А* -работа ( В англоязычной
литературе обозначают также буквой "W" ,
а энергию Гельмгольца - "A "
aB - термодинамическая активность
сP, cV - теплоемкость
c - молярная концентрация
Е - энергия
Е - электродвижущая сила
е - заряд электрона
f - летучесть (фугитивность)
F *- энергия Гельмгольца
F - число Фарадея
G - энергия Гиббса
H - энтальпия
h - калорический коэффициент
I - ионная сила
K - константа химического равновесия
KГ- константа Генри
k - константа скорости химической реакции
l - длина
l - калорический коэффициент
m - моляльная концентрация
М - молекулярная масса
ni - количество молей i- го вещества
P - давление
Q - теплота
R - универсальная газовая постоянная
R - сопротивление
r - радиус иона
S - энтропия
s - площадь
T - абсолютная температура
t - время
ti - число переноса i-го иона
U - внутренняя энергия
U - разность потенциалов
u - абсолютная подвижность иона
V - объем
V - разведение
W - термодинамическая вероятность
w - скорость реакции
w - массовая доля
x - мольная доля
z - заряд иона
Греческий алфавит
![]() - степень диссоциации
- степень диссоциации
![]() - изобарный коэффициент
расширения
- изобарный коэффициент
расширения
![]() i - степень превращения
i-го вещества
i - степень превращения
i-го вещества
![]() - коэффициент сжимаемости
- коэффициент сжимаемости
![]() -
удельная электропроводность
-
удельная электропроводность
![]() -
калорический коэффициент
-
калорический коэффициент
![]() - коэффициент активности
- коэффициент активности
![]() - изохорный коэффициент
давления
- изохорный коэффициент
давления
![]() o - вязкость
o - вязкость
![]() - подвижность
- подвижность
![]() - калорический коэффициент
- калорический коэффициент
![]() - химический потенциал
- химический потенциал
![]() -
стехиометрический коэффициент
-
стехиометрический коэффициент
![]() - осмотическое давление
- осмотическое давление
![]() -
степень заполнения
-
степень заполнения
![]() - плотность
- плотность
![]() 1/2- время полупревращения
1/2- время полупревращения
Кириллица
Г - адсорбция
Надстрочные индексы
о- стандартное состояние
~ - приведенная функция
(р) - раствор
(ж) - жидкость
(г) - газ
(тв) - кристалл
Подстрочные индексы
b - кипение
f - образование
m - плавление
tr - фазовый переход
V- испарение, парообразование
адс - адсорбция
Адсорбция
– изменение концентрации вещества на границе раздела фаз по сравнению с объемом. В настоящее время этим термином обозначают также и процесс поглощения, и количество поглощенного вещества Г, отнесенного к единице площади поверхности или массы адсорбента [ммоль/м2 или в ммоль/г].Адсорбент – вещество, на поверхности которого происходит процесс адсорбции.
Адсорбат – адсорбирующееся вещество.
Адсорбция физическая – адсорбция, обусловленная силами межмолекулярного взаимодействия; как правило - обратима.
Хемосорбция – поглощение газов, паров или растворенных веществ твердыми или жидкими поглотителями, сопровождающееся образованием химических соединений. В отличие от физической адсорбции теплоты хемосорбции близки к теплотам химических реакций ~ 40-400 кДж/моль (см. также теплота адсорбции).
Изотерма адсорбции – функциональная зависимость количества адсорбированного поверхностью вещества от давления или концентрации этого вещества в другой фазе Г = f(P)T=const, Г = f(c)T=const. При монослойной локализованной адсорбции на однородной поверхности Г = f(P) описывается изотермой Лэнгмюра:
![]() ,
, ![]() , при с << 1
, при с << 1
![]()
при с >> 1 ![]() ,
, ![]() =1,
=1,
где q - степень заполнения, Г![]() -
предельная адсорбция, КL - константа
адсорбционного равновесия в первом слое (т.е.
адсорбция по Лэнгмюру), KГ - константа
Генри. Если поверхность энергетически неоднородна,
используют эмпирическое уравнение Френдлиха:
-
предельная адсорбция, КL - константа
адсорбционного равновесия в первом слое (т.е.
адсорбция по Лэнгмюру), KГ - константа
Генри. Если поверхность энергетически неоднородна,
используют эмпирическое уравнение Френдлиха:
Г = x/m = kcn,
где x - количество адсорбированного вещества, m - масса адсорбента, k,n - аппроксимационные параметры.
При многослойной адсорбции изотерма описывается ур-нием БЭТ:
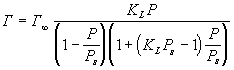
где Ps - давление насыщенного пара адсорбата.
Аккумулятор –
вторичный гальванический элемент, в отличие от первичного г.э. одноразового действия после разряда его можно вновь зарядить, пропуская ток от внешней цепи в противоположном направлении.Емкость – количество электричества, отданное при полном разряде аккумулятора.
Напряжение разомкнутой цепи (н.р.ц.) – напряжение аккумулятора, когда через него не протекает ток.
Ресурс – количество циклов разряда-заряда,
которые может выдержать аккумулятор.
Прим.:
| Тип | Токообразующая реакция |
Н.р.ц. | Ресурс |
| свинцовый | PbO2 + Pb + 2H2SO4 |
2,1 В (заряж.) 2,0 В (разряж.) |
1000 |
| никель-кадмиевый | 2Ni(OH)3 + Cd |
1,30-1,35 В | 4000 |
| серебряно-цинковый | AgO + Zn Ag2O
+ Zn |
1,86 В 1,60 В |
1000 |
Активность a
– безразмерная величина, определяемая для вещества В как отношение разности химических потенциалов этого вещества в данной фазе и стандартном состоянии при одних и тех же P и T к произведению универсальной газовой постоянной R на температуру T:![]()
Активность - "эффективная, исправленная"
концентрация, использование которой позволяет
описывать термодинамические свойства
неидеальных смесей с помощью соответствующих
уравнений для идеальных растворов.
Рассчитывается через коэффициент активности
![]() (моляльный
(моляльный ![]() mi,
молярный
mi,
молярный ![]() ci или
рациональный
ci или
рациональный ![]() xi),
который определяют экспериментально или
оценивают теоретически. Для газовых смесей:
xi),
который определяют экспериментально или
оценивают теоретически. Для газовых смесей: ![]() .
.
Коэффициент активности ![]() – безразмерная величина, показывающая отличие активности
от концентрации; характеризует работу
переноса 1 моля вещества из реальной среды в
идеальную при T, P, x = const.
Численное значение зависит от способа выражения
концентрации и выбора стандартного состояния:
– безразмерная величина, показывающая отличие активности
от концентрации; характеризует работу
переноса 1 моля вещества из реальной среды в
идеальную при T, P, x = const.
Численное значение зависит от способа выражения
концентрации и выбора стандартного состояния:
![]() mi = ai /mi,
mi = ai /mi,
![]() ci. = ai /ci
,
ci. = ai /ci
, ![]() xi = ai /xi
xi = ai /xi
Активность электролитов средняя ионная – среднее геометрическое произведения активностей ионов
![]() ,
,
может быть выражена через активность
электролита a, средний ионный коэффициент
активности ![]()
![]() и концентрацию
(напр., моляльную m или среднюю моляльную m
и концентрацию
(напр., моляльную m или среднюю моляльную m![]() )
)
![]() ,
,
где v+(-)- количество образующихся при диссоциации катионов (анионов).
Коэффициент активности средний ионный ![]() – среднее геометрическое
произведения коэффициентов активностей ионов
– среднее геометрическое
произведения коэффициентов активностей ионов
![]() ;
;
![]()
![]() в общем случае
зависит от конкретного вида ионов, их заряда z+,
z- и концентрации: в разбавленных
растворах коэффициент активности сильного
электролита одинаков для всех растворов одной и
той же ионной силы I (правило
Льюиса-Рендалла). Согласно 1-му приближению
теории Дебая-Хюккеля
в общем случае
зависит от конкретного вида ионов, их заряда z+,
z- и концентрации: в разбавленных
растворах коэффициент активности сильного
электролита одинаков для всех растворов одной и
той же ионной силы I (правило
Льюиса-Рендалла). Согласно 1-му приближению
теории Дебая-Хюккеля ![]()
![]() можно рассчитать по уравнению:
можно рассчитать по уравнению:
lg![]()
![]() =-A| z+z-|
Ц I, lg
=-A| z+z-|
Ц I, lg![]() +=-Az+2Ц
I, lg
+=-Az+2Ц
I, lg![]() -=-Az-2Ц
I,
-=-Az-2Ц
I,
для водного раствора при 25o С А ![]() 0.51.
0.51.