Электронный континуум
Понятие "атом", несмотря на его чрезвычайную значимость и очень частое употребление, имеет достаточно определенный смысл лишь тогда, когда атом является (или считается) изолированным. Всякое взаимодействие между атомами приводит к образованию обобществленного континуального распределения электронной плотности р(r), в которое "вкраплены" атомные ядра. Как в такой системе выделить атомы и указать границы между ними? Стоит основательно разобратъся в этом важном вопросе.
Современные расчетно-теоретические и экспериментальные методы (в первую очередь это квантовохимические расчеты ab initio и прецизионный рентгеноструктурный анализ) позволяют получать весьма надежную информацию о функции р(r) для конкретных химических обьектов. В качестве примера обратимся к распределению электронной плотности в плоской молекуле фторэтилена CH2=CHF.
На рис. 11a изображено
сечение функции р(r), совпадающее с
плоскостью молекулы. Каждая из замкнутых
изолиний соответствует определенному уровню
электронной плотности. Максимумы функции р(r)
приблизительно совпадают с положением ядер
(Оценка расстояний между максимумами р(r) и
средними во времени положениями ядер – сложный
вопрос, обсуждение которого выходит за рамки на
стоящей статьи. Применительно к химической про
блематике практически всегда можно считать, что
эти расстояния пренебрежимо малы). Важно
обратить внимание и на седловые точки. Чтобы
получить из такой "карты" ясные выводы о
состоянии и взаимодействии атомов, чаще всего
используются деформационная электронная
плотность ![]() р(r) и градиентный анализ по
Бейдеру.
р(r) и градиентный анализ по
Бейдеру.
Функция ![]() p(r) определяется как
разность р – ро, где р – наблюдаемое
распределение электронной плотности, ро
– электронная плотность сферически
симметричных, т.е. невзаимодействующих атомов,
расположенных там же, как атомы в
рассматриваемой системе. Мы уже отмечали, что
функция
p(r) определяется как
разность р – ро, где р – наблюдаемое
распределение электронной плотности, ро
– электронная плотность сферически
симметричных, т.е. невзаимодействующих атомов,
расположенных там же, как атомы в
рассматриваемой системе. Мы уже отмечали, что
функция ![]() р(r) представляе собой
перераспределение электронной плотности в
результате взаимодействия атомов, первую
очередь в результате образования химических
связей. Функции ро различных
элементов получают путем квантовохимического
расчета изолированных атомов.
р(r) представляе собой
перераспределение электронной плотности в
результате взаимодействия атомов, первую
очередь в результате образования химических
связей. Функции ро различных
элементов получают путем квантовохимического
расчета изолированных атомов.
Обратимся снова к рис. 46 и
в, где изображены сечения пространственного
распределения деформационной электронной
плотности ![]() р в кристалле формамида H2N
– СНО. В сечении, проходящем через плоскость
молекулы, в местах, где располагаются атомы
(точнее, их ядра), максимумы отсутствуют – это
следстви~ вычитания ро. Зато четко
видны максимумы в связях H(1) – N, H(2) – N, N – С, С – Н
и С=О которые соответствуют электронным парам,
ответственным за образование ковалентньв
связей. Вблизи атома О видны также максимумы
"неподеленных" электронных пар; они
участвуют в формировании межмолекулярньв
водородных связей, изображенных штриховыми
линиями.
р в кристалле формамида H2N
– СНО. В сечении, проходящем через плоскость
молекулы, в местах, где располагаются атомы
(точнее, их ядра), максимумы отсутствуют – это
следстви~ вычитания ро. Зато четко
видны максимумы в связях H(1) – N, H(2) – N, N – С, С – Н
и С=О которые соответствуют электронным парам,
ответственным за образование ковалентньв
связей. Вблизи атома О видны также максимумы
"неподеленных" электронных пар; они
участвуют в формировании межмолекулярньв
водородных связей, изображенных штриховыми
линиями.
Чтобы проиллюстрировать второй подход к интерпретации функции р(r), вернемся к молекуле фторэтилена. Важные свойства этой функции можно выявить с помощью градиентных траекторий, (напомним, что вектор градиента во всякой точке пространства указывает направление наискорейшего изменения функции. Градиентная траектория – это линия, в любой точке которой вектор градиента является касательной) изображенных на рис. 11б. Если считать, что каждая из показанных траекторий начинается в одном из ядер, то можно видеть, что почти все такие линии устремляются в бесконечность, приближаясь к одной из изогнутых характеристических поверхностей, которые то же изображены и на рис. 11б (и на рис. 11a); они называются поверхностями нулевого потока. Исключениями являются градиентные траектории, которые заканчиваются в седловых точках. Пары таких траекторий, соединяющих ядра, играют особую роль: они соответствуют валентным штрихам в классической структурной формуле и называются линиями связи. Таким образом удается связать традиционные представления о химических связях в молекуле с современными данными о распределении электронной плотности.
Еще один примечательный результат векторного (градиентного) анализа функции р(r), раз работанного канадским ученым Р. Бейдером [17], заключается в том, что молекула оказывается разделенной поверхностями нулевого потока на области, каждая из которых содержит одно атомное ядро; эти области, согласно концепции Бейдера, как раз и представляют собой химически взаимодействующие атомы. Не должно вызывать недоумения то, что атомы оказываются отнюдь не сферическими и что не со всех сторон они ограничены, – это вполне в духе современных воззрений.
Казалось бы, бейдеровский подход дает хороший
выход из положения: удалось выделить атомы в
молекуле, обозначен критерий химической связи в
ядерно-электронной системе. К сожалению, столь
ясные результаты, вполне согласующиеся с
классической теорией химического строения,
получаются далеко не всегда:
1) гораздо более сложные ситуации возникают для
некоторых неплоских молекул,
2) линии связи наблюдаются и между атомами примы
кающих друг к другу молекул, 3) градиентный анализ
не позволяет в полной мере выявить особенности
ионной и металлической связи.
Кроме того, ни карты деформационной электронной
плотности, ни градиентный анализ, ни более
сложные методики исследования локальных свойств
распределения р(r) не позволяют сделать
однозначные выводы о химической связи, полностью
согласующиеся с эмпирическим материалом химии.
Причина этого достаточно понятна: химические
связи и их свойства проявляются в полной мере
лишь в процессе превращения вещества, в условиях,
стимулирующих химическую реакцию или фазовый
переход. Химическая связь – это, строго говоря,
не особенность (или совокупность особенностей)
данной статической функции р(r), а некие
инвариантные черты этой функции, т.е.
особенности, сохраняющиеся при видоизменении р(r)
в ходе реакции или фазового перехода, или же,
наоборот, особенности, совершенно определенным
образом модифицирующиеся (в частности,
исчезаюшие), если действию химических агентов
подвергается та самая связь, которая эти
особенности порождает.
Таким образом, полный анализ рассматриваемого крута вопросов требует многократного расчета функции р(r) не только для равновесных конфигураций, соответствующих начальному и конечному состоянию данной системы, но и для промежуточных неравновесных конфигураций, возникаюших в ходе реакции. В настояшее время проведение таких исследований не представляется возможным и наиболее надежные ориентиры в мире химических связей по-прежнему дает всестороннее изучение химических и физических свойств, осуществляемое огромной армией экспериментаторов.
Вместе с тем, изучение топологических
особенностей и количественных характеристик
функций р(r) и ![]() р(r), конечно же, углубляет
наше понимание строения химических веществ и их
превращений. В качестве примера обратимся к
результатам градиентного анализа кристалли
ческого хлора, проведенного в лаборатории
кристаллохимии Химфака МГУ (в группе П. М.
Зоркого) и затем воспроизведенного в работе [18) (с
участием Р. Бейдера). Итоги этих исследований
представлены на рис. 12 и 13.
р(r), конечно же, углубляет
наше понимание строения химических веществ и их
превращений. В качестве примера обратимся к
результатам градиентного анализа кристалли
ческого хлора, проведенного в лаборатории
кристаллохимии Химфака МГУ (в группе П. М.
Зоркого) и затем воспроизведенного в работе [18) (с
участием Р. Бейдера). Итоги этих исследований
представлены на рис. 12 и 13.
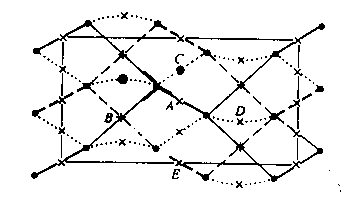 |
Рис.13.Седловые точки и связевые пути
(линии связи) в кристаллах хлора Сплошные линии - связевые пути, лежащие в плоскости чертежа, штриховые линии - связевые пути, расположенные параллельно этой плоскости, пунктирные линии - наклонные связевые пути. Седловые точки обозначены крестиками |
Согласно этим данным каждый атом Cl образует семь связей (одну внутри молекулы и шесть межмолекулярных). Носителями седловых точек являются ковалентная связь (точка А на рис. 13), два сокращенных контакта длиной 3,27 А в слое, параллельном плоскости YZ, и наклонные контакты длиной 3,70 и 3,92 А, кратность каждого из которых равна 2 благодаря плоскости симметрии, совпадающей с плоскостью слоя. Здесь появляются основания для введения понятия "ван-дер-ваальсовой связи". Обращает на себя внимание примечательное обстоятельство: более короткие, чем 3,92 А, контакт длиной 3,74 А (в слое) и два контакта длиной 3,82 А (между слоями) не являются "ван-дер-ваальсовыми связями". Таким образом, еще раз – уже на более глубоком уровне – подтверждается родство кристаллических структур хлора и галлия (рис. 10): в обеих этих структурах каждый атом дает семь связей, но есть некоторые (второстепенные) различия в их топологии (табл. 4).
Продолжение