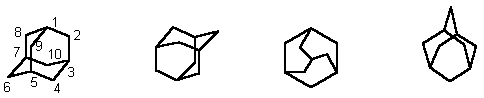
Задача спецпрактикума для студентов IV курса кафедры химии нефти и органического катализа.
Тема: Синтетические задачи
Цель работы: Изучение способов получения и химических свойств уникального насыщенного углеводорода адамантана, который был найден в 1933 году в нефти чешскими учеными С. Ланда и Махачеком и на основе которого было развито новое направление в органической химии - химия полиэдранов.
Введение. Адамантан 1- трицикло[3.3.1.13,7]декан - трицикличесий мостиковый углеводород состава С10H16, молекула которого состоит из трех циклогексановых колец в конформации кресло; пространственное расположение атомов углерода в молекуле адамантана такое же, как и в кристаллической решетке алмаза. Обычно адамантан изображают одним из следующих способов:
Адамантан является родоначальником гомологического ряда семейства углеводородов алмазоподобного строения - диамантана, триамантана и т.д. На основе химии адамантана возникла и развилась одна из областей современной органической химии - химия органических полиэдранов [1-6]. Производные адамантана уже нашли практическое применение в качестве лекарственных препаратов, обладающих противовирусной активностью, антипаркинсонической активностью, на основе адамантана разрабатываются полимерные материалы и композиции с улучшенными эксплутационными свойствами, термостабильные смазочные материалы и т.п..
Способы получения адамантана.
Природные источники. В настоящее время единственным известным природным источником адамантана является нефть. Впервые адамантан был выделен из нефти Годонинского месторождения, раньше чем он был синтезирован в лаборатории. Впоследствии адамантан был найден в ряде нефтей других месторождений. Содержание адамантана в нефти в зависимости от ее характера составляет 0.03 - 0.0001%, обычно это содержание больше для нефтей с большим содержанием нафтеновых углеводородов. К настоящему времени в нефти найдено около тридцати углеводородов ряда адамантана, общее содержание которых в 10 и более раз превышает содержание самого адамантана.
Лабораторные и промышленные методы. Соединения со структурой адамантана давно привлекало внимание химиков, т.к. можно было ожидать необычных свойств у такого соединения. Еще в 1924 году на Конгрессе естествоиспытателей и врачей в Инсбруке Деккер высказал недоумение по поводу того, что такой углеводород, который он назвал декатерпеном, не был еще синтезирован.
В том же 1924 году Меервейн попытался синтезировать этот углеводород, но безуспешно. Конденсаций малонового эфира с формальдегидом в присутствии пиперидина он получил тетраметиловый эфир бицикло[4.3.1]нонадион-2,6-тетракарбоновой -1,3,5,7 кислоты, впоследствии названный эфиром Меервейна (2).
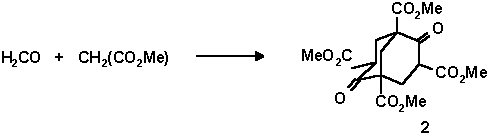
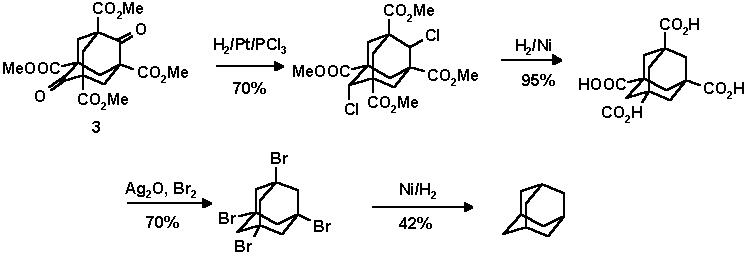
В последствии эфир 2 стал исходным сырьем для синтеза адамантана и его гомологов. Впервые адамантан синтетическим путем удалось синтезировать в 1941 году Прелогу по следующей схеме:
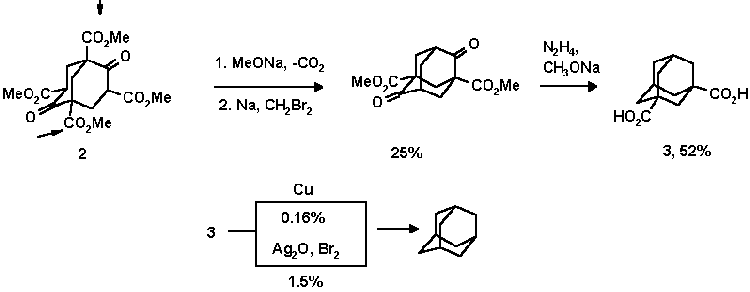
Позднее Штеттер повысил выход адамантана из эфира Меервейна до 6.5%:
Широкое развитие химии адамантана началось с 1957г, когда Шлейер и Дональдсон сделали его по настоящему доступным. Они установили, что при изомеризации эндо-тетрагидродициклопентадиена в его экзо-форму в присутствии хлористого алюминия или кислот Льюса образуется адамантан:
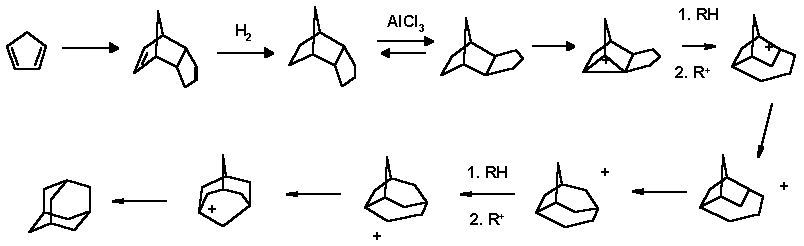
Хотя этот процесс дает адамантан с выходом 15-20%, он привлекателен тем, что исходное соединение легко доступно, так как является побочным продуктом нефтехимических производств. Позднее, были предложены процессы изомеризации под давлением водорода с использованием хлорида алюминия активированного хлористым водородом или бромида алюминия и другие модификации.
Гомологи адамантана получаются по этому методу действием галогенида алюминия при температурах от -5 до +50o С на пергидроароматические углеводороды, которые состоят из трех колец и содержат не менее 12 углеродных атомов в молекуле:
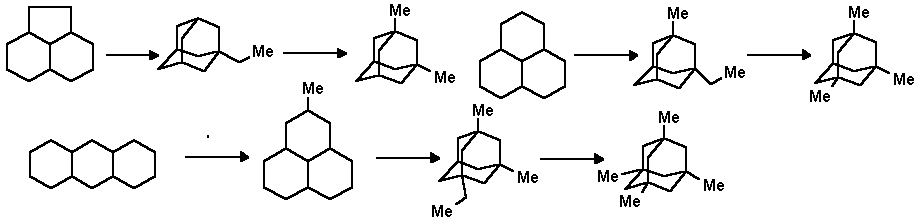
Круг соединений, способных изомеризоваться в адамантановую структуру, в настоящее время настолько широк, что термин "адамантизация" кажется сейчас уже совершенно естественным и правомерным. Изомеризация холестерола, холестана, абиетиновой кислоты, сквалена, цедрена, кариофилена, циклогексана, сквалана, додекана приводит к образованию смеси алкиладамантанов с выходом 2-45% [1-3].
Следует отметить, что процессы использующие галогениды алюминия обладают значительными недостатками: (а) большое количество побочных продуктов и довольно сложное выделение; (б) много катализатора и трудно его регенировать; (в) необходима процедура разложения катализатора; (г) реактор легко коррозирует. Были изучены алюмосиликатные катализаторы пропитанные серной кислотой, но они имели незначительную активность и экстремально короткое время жизни. Недавно удалось разработать цеолитный катализатор, у которого нет большинства указанных выше недостатков, и понизить цену на адамантан в два раза [4].
Что касается других методов получения адамантановых структур, то наиболее распространенными являются методы синтеза циклизацией производных бициклононана. Хотя такие методы многостадийны, они позволяют получать производные адамантана с заместителями, которые трудно получить иным путем:
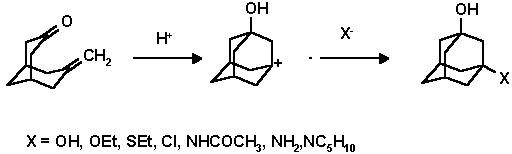
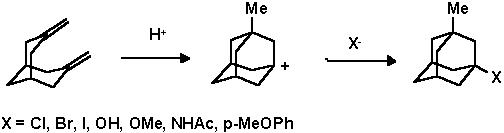
Функционализация узловых положений адаманатанового ядра.
Несмотря на то, что адамантан является насыщенным углеводородом и несмотря на то, что для многих полициклических систем была показана низкая реакционная способность узловых положений (Табл. 1), для адамантана наиболее характерными являются ионные реакции и прежде всего с образованием 1-адамантильного катиона. Собственно легкость и селективность функционализации адамантана и определили успешное развитие его химии. Так как третичный адамантильный катион более стабилен чем вторичный (Табл. 2), реакции замещения протекают в большинстве случаев только по узловому положению.
Таблица 1. Реакционная способность трет-галогенидов в реакции сольволиза
| R-Br | трет-Бутилбромид | 1-бромадамантан | 1-бромбициклооктан | 1-бромбициклогептан |
| котн | 1 | 10-3 | 2.4х10-7 | 10-14 |
Для оценки энергий напряжения и стабилизации в
1-Ad+ и 2-Ad+ методом фотоэлектронной спектроскопии
были определены стандартные энтальпии
образования (![]() Hfo) и
энергии сродства к гидрид-иону [D(R+-H)].
Hfo) и
энергии сродства к гидрид-иону [D(R+-H)].
Таблица 2. Стандартные энтальпии
образования (![]() Hfo) и
энергии сродства к гидрид-иону [D(R+-H)] трет-алкильных
катионов
Hfo) и
энергии сродства к гидрид-иону [D(R+-H)] трет-алкильных
катионов
| Катион | D(R+-H)] ккал/моль | |
| 1-Ad+ | 158.0 | 224.0 |
| 2-Ad+ | 167.5 | 233.8 |
| t-Bu+ | 164.8 | 231.9 |
1-Адамантилный катион устойчив в сильно кислых средах и при низких температурах. Обычно он генерируется из 1-фтор-, хлор-, оксиадамантанов в суперкислотах (SbF5) или в "магической кислоте" (SbF5 в HSO3F) в среде SO2 и SO2ClF. В 1986 году впервые был сделан рентгеноструктурный анализ для органического карбокатиона, полученного из 1-фторадамантана:
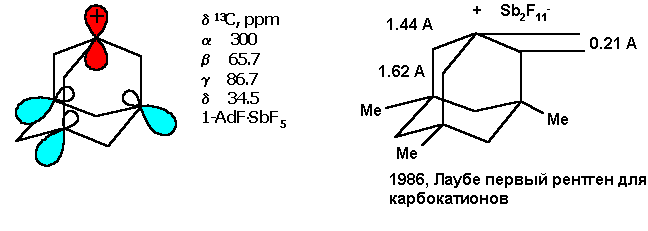
Синтез 1-замещенных адамантанов
Производные адамантана, содержащие заместители в узловых положениях адаманатового ядра, являются наиболее доступными. Это связано с тем, что для адамантана наиболее характерными являются ионные реакции и прежде всего реакции с образованием 1-адамантильного катиона. В качестве классической и очень широко используемой реакции для функционализации адамантанового ядра используется бромирование адамантана. В зависимости от условий могут быть получены все - от моно- до тетра- замещенных галоидадамантанов:
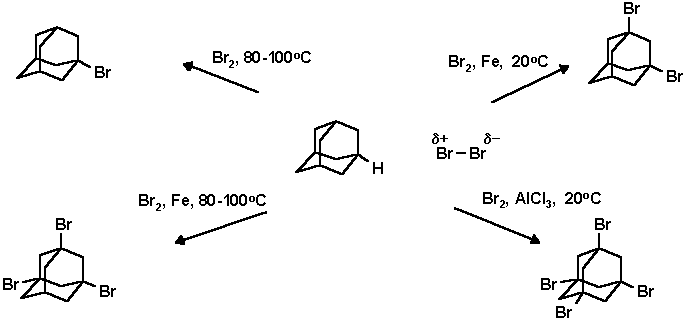
Таким образом, для того чтобы ввести функциональную группу в узловое положение адамананового ядра нужно подобрать подходящий акцептор гидрид-иона и ввести в систему соответствующий нуклеофил. Так, например, были предложили реакции карбоксилирования и аминирования адамантана с использованием трет-бутилкатиона, генерируемого в серной кислоте:
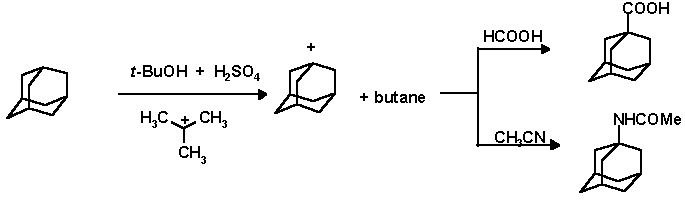
Интересный способ активации С-H в адамантановом ядре предложил Ола с помощью хлористого алюминия в хлористом метилене в присутствии трехлористого фосфора. В результате реакции образуются дихлорфосфорилированные производные с выходами 40-60%.
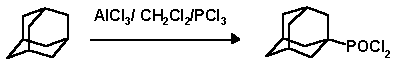
В последние годы появились новые способы функционализации адамантанового ядра, связанные с использованием разнообразных окислительных систем и введением кислород-, фософор- и азотсодержащих функциональных групп в узловые положеения:
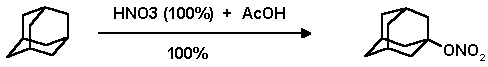
Метод функционализации уловых положений адаманаового ядра используется и для получения полизамещенных 1,3-, 1,3,5- и 1,3,5,7-замещенных адамананов с различными заместителями в адамантановом ядре. Так, смесь 65% азотной и 97% серной кислот была использована для синтеза оксиаминов адамантанового ряда
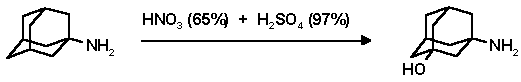
Существует ряд методов получения полизамещенных адамантанов особенно характерных именно для адамантановых производных. Большинство из них основано на реакциях изомеризации. Например, 3-изо-пропил-1-адамантанол может быть получен с препаративным выходом в результате изомеризции 2-(1-адамантил)пропанол-2 в кислой среде:
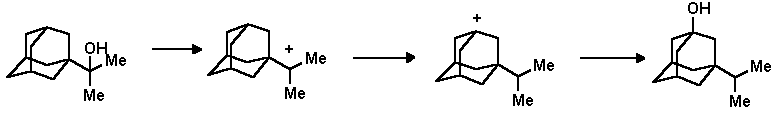
В настоящем сборники приведены классические способы синтеза некоторых 1- и 1,3-дизамещенных адамантанов, основанные как на методах функционализации узловых положений, так и модификации существующих групп.
Методики синтеза 1-замещенных адамантанов функционализацией адамантанового ядра.
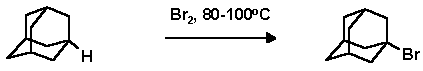
В трехгорлую колбу снабженную механической мешалкой, капельной воронкой и обратным холодильником помещают 136 г (1 моль) адамантана и при перемешивании и нагревании на воздушной бане при температуре 85o С по каплям в течение 5 часов прибавляют 207 мл (4 моль) брома. По окончании добавления брома смесь нагревают 6 часов при температуре воздушной бане (105-108o С). После охлаждения в реакционную массу приливали 150 мл четыреххлористого углерода и отгоняют раствор брома в ССl4. Операцию повторяют до тех пор пока отгоняющийся растворитель не станет почти бесцветным. К остатку добавляют 200 мл ССl4 и промывают 10% сульфитом натрия а затем водой, высушивают над сульфатом магния. После отгонки растворителя остаток хроматографируют на оксиде алюминия, элюент - ССl4. Выход 1-бромадамантана: 198.5 г (92.5%); т. пл. 115-117o C; Rf 0.22 (н-пентан).
Литература:
Stetter H., Schwarz M., Hirschhorn A. Uber verbingbungen mit Urotropin - Structur. XII.
Monofunktionelle Adamantan - Derivate.
Chem. Ber., 1959, 9(27), 1629-1635.
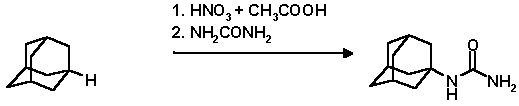
В смеси 15 мл 98% НNO3 и 8 мл СН3СООН при 25o С растворяют 4 г адамантана, добавляют 6 г мочевины, выдерживают 2 часа при 70o С и выливаю в воду. Продукт реакции отфильтровывают и промывают водой. Выход N-(1-адамантил)мочевины 3.14 г (55%); т. пл. 270-272o С.
Литература:
Климочкин Ю. Н., Моисеев И. К.
Ж. Орг. Хим., 1987, 23(9), 2025.
Методики синтеза 1-замещенных адамантанов модификацией функциональных групп.

В колбу с обратным холодильником помещают 55.4 г (0.26 моль) 1-бромадамантана, 62 мл 20% НСl и 65.4 мл диметилформамида и слабо кипятят в течение 10 часов. Выпавший осадок отфильтровывают на воронке Бюхнера, промывают водой до нейтральной реакции, высушивают на воздухе. Перекристаллизовывают из смеси этанол-вода (1:1). Выход 1-гидроксиадамантана 35 г (90%); т. пл. 280-281o C ; Rf 0.51 (СНСl3 : ацетон, 20:1);
Литература:
Geluk H., Schlatmann J. Hydride Transfer Reactions of the Adamantyl Cation. I. A New and
Convinient Synthesis of Adamanatanone.
Tetrahedron, 1968, 24(15), 5361-5368.
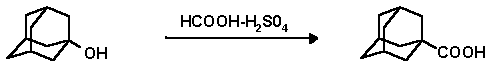
В плоскодонную колбу с м.агнитной мешалкой, капельной воронкой и обратным воздушным холодильником помещают 30 г (0.20 моль) 1-гидроксиадамантана, 257 мл (4.80 моль) конц. H2SO4 и в течение 2 часов прикапывают 8.3 мл (0.22 моль) муравьиной кислоты при температуре 10o C. После этого температуру повышают до комнатной и реакционную смесь перемешивают в течение суток. При этом температуру повышают до комнатной. Затем реакционную смесь выливают в 800 мл воды и оставляют до следующего дня. Осадок отфильтровывают на воронке Бюхнера и дважды переосаждают (насыщ. р-р Na2CO3 - конц. HCl). Высушивают в пистолете Фишера. Выход 1-адамантанкарбоновой кислоты 32.7 г (92%); т. пл. 174-176o C; Rf 0.53 (СНСl3 : ацетон, 20:1);
Литература:
Langhals H., Mergelsberg J., Ruchardt C. Synthesis of 13C=O - labelled tertiary alkonoic
acids by the Koch-Haff reactiojn.
Tetrahedron Lett., 1981, 22(25), 2365-2366.
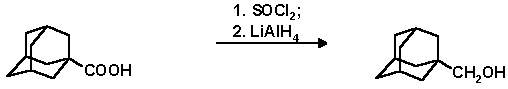
В трехгорлую колбу снабженную механической мешалкой, капельной воронкой и обратным холодильником помещают 9 г (50 ммоль) 1-адамантанкарбоновой кислоты и 29.8 г (18 мл, 250 ммоль) свежеперегнанного хлористого тионила. Смесь нагревают на кипящей водяной бане при перемешивании в течение 45 мин. до полного растворения кислоты. Охлаждают колбу, приливают 30 мл абсолютного бензола, избыток хлористого тионила удаляют отгонкой в вакууме с абсолютным бензолом. Операцию повторяют 3 раза. На следующий день полученный хлорангидрид 1-адамантанкарбоновой кислоты растворяют в 100 мл абсолютного тетрагидрофурана. К раствору при перемешивании и охлаждении льдом порциями прибавляют 1.9 г (50 ммоль) литийалюмогидрида. По окончании прибавления литийалюмогидрида содержимое колбы кипятят при перемешивании 5 часов. Смесь охлаждают, затем прикапывают 5%-ный раствор едкого кали. Фильтрат упаривают на роторном испарителе до 20 мл, для осаждения образовавшегося спирта приливают воду. Продукт отфильтровывают. Эфирные вытяжки упаривают и объединяют с основным веществом. Спирт перекристаллизовывают из н-гексана. Выход 1-гидроксиметиладамантана 7.31 г (88%); т. пл. 111-113o C: Rf 0.44 (н-гексан-эфир, 1:1)
Литература:
Fieser L., Hazer M., Archer S., Berberian, O., Slighter, R.
J. Med. Chem., 1967, 10(4), 517-521.
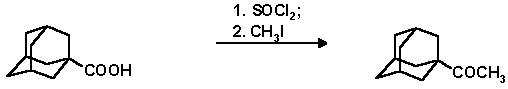
В коническую колбу с обратным холодильником и магнитной мешалкой помещают 1.8 г (75 ммол) стружек магния и 20 мл абсолютного диэтилового эфира. Добавляют при перемешивании раствор 10.7 г (4.67 мл, 75 ммол) метилиодида в 10 мл абсолютного эфира и кипятят при перемешивании до полного растворения магния. Хлорангидрид 1-адамантанкарбоновой кислоты получают из 9 г (50 ммоль) 1-адамантанкарбоновой кислоты и 28.8 г (18 мл, 150 ммол) хлористого тионила, аналогично описанному выше (п. 2.3.). В трехгорлую колбу снабженную механической мешалкой, капельной воронкой и обратным холодильником помещают раствор хлорангидрида 1-адамантанкарбоновой кислоты в 150 мл диэтилового эфира, 0.6 г (6.1 ммол) хлорида меди и осторожно прикапывают эфирный раствор реактива Гриньяра. Реакционную смесь кипятят в течение 1.5 часов. Колбу охлаждают, разлагают реакционную смесь прибавлением 5% раствора соляной кислоты до кислой реакции, добавляют воду и несколько раз экстрагируют эфиром. Эфирные вытяжки высушивают над сульфатом магния. Остаток после отгонки эфира хроматографируют на силикагеле, элюенты - гексан, гексан-эфир 1:1. Контроль за ходом разделения осуществляют с помощью ГЖХ. Выделяют в порядке элюирования: 1-адамантилметилкетон, 5.4 г (60.1%); т. пл. 52-54o C, 53-54o C Rf0.83 (гексан); 1-адамантилдиметилкарбинол, 1.5 г (15.6% ); т. пл. 99-80o C, Rf 0.41 (гексан-эфир, 1:1).
Литература:
Hala S., Landa S. Uber Adamantan und dessen Derivate. VI. Uber eine neue Darstellungsweise
von 1-Athyladamantan und dessen Eigenschaften.
Coll.Czech.Chem.Commun., 1960, 25, 2692-2695.
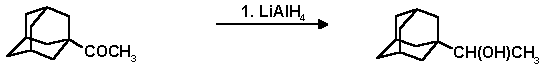
В трехгорлую колбу снабженную механической мешалкой, капельной воронкой и обратным холодильником помещают 1.4 г (30 ммоль) литийалюмогидрида, 75 мл абсолютного эфира и прибавляют по каплям эфирный раствор 5.34 г (30 ммоль) 1-адамантилметилкетона. Реакционную смесь кипятят при перемешивании 6 часов, затем разлагают водой и 5%-ным раствором соляной кислоты до полного растворения основных солей алюминия. Экстрагируют эфиром, эфирные вытяжки промывают водой до нейтральной реакции, сушат над сульфатом магния, растворитель отгоняют, остаток перекристаллизовывают из пентана. Выход 1-адамантилметилкарбинола 4.84 г (89%); т. пл. 73-75o C; Rf 0.28 (гексан-эфир, 1:1).
Литература:
Raber D., Fort R., Wiskott E., Woodwokth C., Schleyer P., Weben J., Stetter H.
Rearrangemnet in the Adamantane Series. Hydide Shifts of the 2-(1-Adamantyl)-2-propyl
Cation.
Tetrahedron, 1971, 27(1), 3-18.
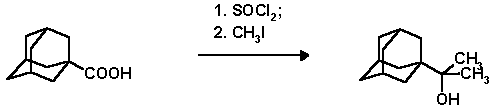
Хлорангидрид 1-адамантанкарбоновой кислоты готовят из 9.0 г (50 ммоль) 1-адамантанкарбоновой кислоты и 28.8 г (18 мл, 150 ммоль) хлористого тионила, аналогично описанному выше (п. 2.3.). В трехгорлую колбу снабженную механической мешалкой, капельной воронкой и обратным холодильником помещают раствор хлорангидрида 1-адамантанкарбоновой кислоты в 150 мл абсолютного эфира и прибавляют по каплям в течение 30 мин. эфирный раствор реактива Гриньяра, приготовленного из 3.6 г (150 ммоль) стружек магния и 21.3 г (9.35 мл, 150 ммоль) метилиодида. Смесь кипятят при перемешивании в течение 2.5 часов, затем охлаждают, разлагают насыщ. раствором NH4Cl и несколько раз экстрагируют эфиром. Органический слой высушивают над сульфатом магния, растворитель отгоняют. Остаток хроматографируют на силикагеле. Элюенты - гексан. гексан-эфир 1:1. Контроль за ходом разделения осуществляют с помощью ГЖХ. Выход 1-адамантилдиметилкарбинола, 7.86 г (80.1%); т. пл. 99-80o C; Rf 0.41 (н-гексан-эфир, 1 : 1).
Литература:
Stetter H., Raucher E. Zur Kenntnis der Adamantyl-(1)-oxopropion-saure-athylesters.
Chem. Ber., 1960, 93(9), 2054-2057.
Смесь 0.9 г (6 ммоль) 1-адамантанола, 0.54 г (0.62 мл, 6 ммоль) толуола и 1.88 мл (2.89 г, 25 ммоль) ТФК выдерживают в закрытой колбе 12 ч при комнатной температуре. Смесь разлагают 1 N раствором KOH и кипятят в течение 1 ч, экстрагироуют эфиром, высушивают над MgSO4, растворитель отгоняли, остаток перекристаллизовывают из этанола. Выход 1.17 г (90% ); т. пл. 98-99oС.
Литература:
Ковалев В. В. Химия производных адамантана.
Электрофильные реакции в трифторуксусной
кислоте и трифторуксусном ангидриде.
Дисс. на соиск. уч. ст. докт. хим. наук. Москва 1990.
Методики синтеза 1,3-дизамещенных адамантанов функционализацией узловых положений
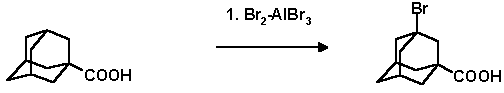
100 мл безводного брома (перегнан над Р2О5) и 60 г безводного AlBr3 в 250 мл трехгорлой колбе охлаждают до 0єС, в течение 4 часов прибавляют 30г 1-адамантанкарбоновой кислоты при 0єС и перемешивании. Смесь стоит 10 часов при температуре 0-10єС, потом перемешивают 5 часов при 20 С, добавляют 500 г льда и 500 мл бензола или 300 мл хлороформа, добавляют пиросульфит натрия. Затем воду дважды экстрагируют бензолом, бензольные вытяжки промывают 0.5 N NaOH (2х100 мл), щелочной раствор экстрагируют 100 мл эфира, а потом подкисляют 2N H2SO4, осадок оставляют на ночь. Выход сырой 3-бром-1-адамантан карбоновой кислоты35.8 г, после перекристаллизации из циклогексана 29.3г (68%), т. пл. 146.5єС.
Литература:
Stetter H., Mayer J. Chem. Ber. 1962, 95, 667.
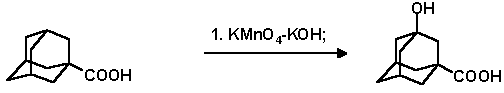
(а) В термостатируемую колбу с магнитной мешалкой помещают 2 г KMnO4 и 25 мл 2%-го раствора KOH (0.5 г КОН + 24.5 мл воды). При 35o C и перемешивании порциями в течение 40 мин. прибавляют 2 г 1-адамантанкарбоновой кислоты, после чего смесь при перемешивании выдерживают ещё 1 час. Охлаждают до комнатной температуры, выливают в 50 мл конц. НСl и оставляют на ночь. На следующий день осадок отфильтровывают, промывают водой, небольшим количеством раствора щавелевой кислоты, снова водой. Высушивают, промывают сухим эфиром. Выход 3-гидрокси-1-адамантанкарбоновой кислоты, 0.8 г (35% ); т. пл. 207-208o C; Rf 0.29 (СНСl3 : ацетон, 20 : 1). Из эфирной вытяжки выделено дополнительно 0.49 г смеси 1-гидроксиадамантан-3-карбоновой кислоты и непрореагировавшей 1-адамантанкарбоновой кислоты.
Литература:
Anderson G., Burks W., Harruna I.
Synth. Commun. 1988, 18(16/17), 1967-1974.
(б) К смеси 15 г 1-адамантанкарбоновой кислоты и 50 мл безводного Br2 прибавляют по каплям в течение 1.5-2 часов при 0-5o С без доступа влаги раствор 30 г AlBr3 в 50 мл сухого брома. Смесь выдерживают 15 часов при 15-20o С и выливают на 500г льда. Избыток брома полностью удаляют обработкой реакционной смеси при 15-20o С твердым тиосульфатом натрия. Осадок отфильтровывают, промывают водой, сушат, растворяют в 200 мл хлороформа. Раствор обрабатывают 1 N NaOH и подкисляют 2 N H2SO4 и отфильровывают кислоту. Выход 12.3 г , т. пл. 203-5o С (из 20% водного ацетона).
Литература:
Фридман А. Л., Сивкова М. П., Колобов Н. А.
Ж. Орг. Хим, 1976, 12(10), 2260-2261.
Раствор 57 г 1-адамантилуксусной кислоты в 150 мл брома перемешивают 18 часов при комнатной температуре и затем 6 часов кипятят. После удаления избытка брома в вакууме продукт реакции очищают от брома сульфитом натрия. Выход 76.3 г (95%), т. пл. 198-199єС (из бензола).
Литература:
Bott K. Chem. Ber. 1968, 101, 564-573.
В трехгорлую колбу, снабженную обратным холодильником с хлоркальциевой трубкой, капельной воронкой и механической мешалкой, помещают 1 г (4.4 ммоль) 1-(4-метилфенил)адамантана, 3.53 г (5.56 мл, 74.8 ммоль) ТФК в 3 мл хлористого метилена. Реакционнную смесь нагревают до кипения и в течение 2 ч при перемешивании прикапывают раствор 0.66 г (0.84 мл, 8.9 ммоль) трет-бутилового спирта в 3 мл хлористого метилена. По окончании прибавления спирта смесь кипятят еще 7 ч. Контроль за ходом реакции осуществляют с помощью ТСХ. Затем в слабом вакууме отгоняют растворитель и избыток ТФК, реакционную смесь разлагают кипячением с 1 N раствором KOH в течение 1 ч., экстрагируют эфиром, высушивают над MgSO4, эфир отгоняют. Остаток хроматографируют на силикагеле (элюенты - бензол, хлороформ). Полученный 3-(4-метилфенил)-1-адамантанол кристаллизуют из н-гептана. Выход спирта 0.32 г (30%); т. пл. 122-123 oС.
Литература:
Ковалев В. В. Химия производных адамантана.
Электрофильные реакции в трифторуксусной
кислоте и трифторуксусном ангидриде.
Дисс. на соиск. уч. ст. докт. хим. наук. Москва 1990.
Методики синтеза 1,3-дизамещенных адамантанов модификацией функциональных групп.
150 г 3-Бром-1-адамантилуксусной кислоты, 600 г метанола и 3 г серной кислоты кипятят 5 часов. Избыток метанола отгоняют, к остатку добавляют воды и экстрагируют эфиром. Выход метилового эфира 3-бром-1-адамантилуксусной кислоты 148 г (93%); т. пл. 30-31 єС.
Литература:
Bott K. Chem. Ber. 1968, 101, 564-573.
Раствор 5 г 3-бром-1-адамантилуксусной кислоты в 350 мл 0.15N NaOH после 15 часового стояния при 20єС подкисляют разб. серной кислотой и экстрагируют эфиром. Выход 3-гидрокси-1-адамантилуксусной кислоты 3.8 г (99%), т. пл. 127-128оС (из бензола).
Литература:
Bott K. Chem. Ber. 1968, 101, 564-573.
Литература