ВАРИАНТЫ С РЕШЕНИЯМИ
Вариант 22
1. Приведите примеры химических реакций, для
которых при постоянных температуре и давлении ![]() U <
U < ![]() H и
H и ![]() U=
U=![]() H. Укажите
выбранную Вами модель.
H. Укажите
выбранную Вами модель.
2. Найдите ![]() U,
U, ![]() H,
H, ![]() S,
S, ![]() F и
F и ![]() G при
обратимом адиабатическом сжатии n молей
кислорода, взятого при температуре Т1 и
давлении Р1 = 1 до давления Р2. Газ
считать идеальным. Нужны ли дополнительные
справочные данные для решения этой задачи?
G при
обратимом адиабатическом сжатии n молей
кислорода, взятого при температуре Т1 и
давлении Р1 = 1 до давления Р2. Газ
считать идеальным. Нужны ли дополнительные
справочные данные для решения этой задачи?
3. Энтальпия испарения воды при 373 К и давлении 1 атм равна 9710 кал/моль, а теплоемкости жидкой воды и пара равны 18,0 и 8,4 кал/моль? К соответственно. Как оценить энтальпию испарения воды при 383 К (Р2 > 1 атм)? Ответ поясните.
4. Для реакции Н2О (г) + СО (г) ![]() Н2 (г) + СО2 (г)
температурная зависимость константы равновесия
имеет вид lg KР = - a + b/T, где a и b -
постоянные. Зависит ли энтальпия этой реакции от
температуры? Как изменится выход продуктов при
увеличении общего давления в системе? Газы
считать идеальными.
Н2 (г) + СО2 (г)
температурная зависимость константы равновесия
имеет вид lg KР = - a + b/T, где a и b -
постоянные. Зависит ли энтальпия этой реакции от
температуры? Как изменится выход продуктов при
увеличении общего давления в системе? Газы
считать идеальными.
5. В опыте g2 г твердого вещества были
растворены в g1 г растворителя, при этом
температура кипения увеличилась от Т1 до Т2.
Найдите молярную массу растворенного вещества,
если молярная масса растворителя - М1, а
энтальпия испарения ![]() H кДж/моль
при Т1. При каких условиях этот метод можно
использовать для определения молярной массы
веществ?
H кДж/моль
при Т1. При каких условиях этот метод можно
использовать для определения молярной массы
веществ?
6. Предложите гальванический элемент и
способ для определения стандартного
электродного потенциала ![]() при Т = 298 К, если известны значения
стандартной энтальпии образования иона Ni2+ (р-
р) и стандатных энтропий Ni (тв), Ni2+ (р- р)
и Н2 (г), а стандартные энтальпия
образования и энтропия Н+ (р- р) равны 0.
при Т = 298 К, если известны значения
стандартной энтальпии образования иона Ni2+ (р-
р) и стандатных энтропий Ni (тв), Ni2+ (р- р)
и Н2 (г), а стандартные энтальпия
образования и энтропия Н+ (р- р) равны 0.
7. Оцените величину энергии активации для химических реакций, к которым применимо правило Вант-Гоффа при 250 С.
Решение варианта 22
1. ![]() U =
U = ![]() H -
H - ![]() nRT, газы идеальные;
nRT, газы идеальные;
![]() n > 0,
n > 0, ![]() U <
U < ![]() H, например: СО(NH2)2
(тв.) + Н2О (ж) = СО2 (г) + 2NH3 (г),
H, например: СО(NH2)2
(тв.) + Н2О (ж) = СО2 (г) + 2NH3 (г),
![]() n = 3;
n = 3;
![]() n = 0,
n = 0, ![]() U =
U = ![]() H, например: С6Н12О6
(тв.) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
H, например: С6Н12О6
(тв.) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
2. CV = 2,5R; CP = 3,5R; ![]() =
CP/CV = 1,4
=
CP/CV = 1,4
T2 = T1[P1/P2](1/![]() - 1),
- 1), ![]() Т = Т2
- Т1,
Т = Т2
- Т1,
![]() U = nCV
U = nCV![]() Т;
Т;
![]() H = nCP
H = nCP![]() Т;
Т; ![]() S = 0;
S = 0; ![]() F =
F = ![]() U - n
U - n![]() Т? S0Т1;
Т? S0Т1;
![]() G =
G = ![]() H -
H - ![]() Т nS0Т1,
Т nS0Т1,
из справочника нужно взять значение S0Т1 кислорода.
3. Согласно уравнению Клаузиуса-Клапейрона
при изменении температуры фазового перехода
изменяется и давление, при котором он происходит.
Однако для приближенной оценки энтальпии
испарения можно использовать формулу Кирхгофа: (![]()
![]() VH/
VH/![]() T)P
T)P ![]()
![]() CP; поскольку
CP; поскольку ![]() CP < 0, то энтальпия
испарения с увеличением температуры будет
уменьшаться:
CP < 0, то энтальпия
испарения с увеличением температуры будет
уменьшаться: ![]() VH383 =
VH383 = ![]() VH373 +
VH373 + ![]() CР
CР![]() Т= 9710 - 96 = 9614 (кал/моль).
Т= 9710 - 96 = 9614 (кал/моль).
4. ![]() H = RT2(d ln KР/dT)Р
= 2,303Rb, т.е. не зависит от температуры.
H = RT2(d ln KР/dT)Р
= 2,303Rb, т.е. не зависит от температуры.
(![]() ln KN/
ln KN/![]() P)T
= -
P)T
= - ![]() V/RT,
V/RT, ![]() V = 0, т.е.
выход продуктов не изменится при увеличении
общего давления, если газы идеальные.
V = 0, т.е.
выход продуктов не изменится при увеличении
общего давления, если газы идеальные.
5. ![]() T = E? m, где m - моляльность
раствора, E = M1RT12/
T = E? m, где m - моляльность
раствора, E = M1RT12/![]() H, тогда
H, тогда
М2 = g2M1RT121000/g1![]() T?
T? ![]() H, при
условии термостабильности растворенного
вещества при Т2. Раствор считать идеальным.
H, при
условии термостабильности растворенного
вещества при Т2. Раствор считать идеальным.
6. Pti Nii NiCl2 (водный р- р) || НСl (водный р- р) | Н2 | Pt
![]()
![]()
На левом электроде: Н+ + е ![]() 0,5Н2
0,5Н2
На правом электроде: 0,5Ni - e ![]() 0,5Ni2+
0,5Ni2+
![]() = -
= - ![]() rG0/nF
= (-
rG0/nF
= (- ![]() rH0 + 298?
rH0 + 298? ![]() rS0)/F
rS0)/F
![]() rH0 = - 0,5
rH0 = - 0,5![]() fH0 (Ni2+(р- р));
fH0 (Ni2+(р- р)); ![]() rS0 = - 0,5[S0 (Ni2+ (р-
р)) + S0 (Н2 (г)) - - S0 (Ni (тв.))].
rS0 = - 0,5[S0 (Ni2+ (р-
р)) + S0 (Н2 (г)) - - S0 (Ni (тв.))].
7. Пусть скорость реакции изменилась в 2 раза
при увеличении
температуры от 298 до 308 К, тогда: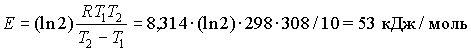 .
.
Рекомендуемая литература: