ВАРИАНТЫ С РЕШЕНИЯМИ
Вариант 17
1. В области температур от 298 до 1000 К теплоемкость вещества А описывается следующим уравнением: СP = а + bT + cT2, где а, b и с постоянные. Рассчитать изменение энтальпии и энтропии вещества при нагревании от 300 до 500 К.
2. Калорийность сахара равна 4 ккал/г. Как экспериментально определить эту величину? Как она связана со стандартной энтальпией сгорания сахара?
3. Напишите недостающие члены в уравнении
U = ![]() +....?....
+....?....
4. Константа скорости реакции следующим образом зависит от температуры (см. рис.). Какие выводы можно сделать об опытной энергии активации этой реакции? Можно ли эти выводы распространить на реакцию, протекающую с заметной скоростью только в присутствии фермента?
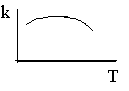
5. Осмотическое давление крови человека равно 7,7 атм при "нормальной" температуре. Рассчитать концентрацию изотонического (имеющего такое же осмотическое давление) раствора хлорида натрия.
6. Фермент алкогольдегидрогеназа (АДГ) катализирует окисление этилового спирта до ацетальдегида в соответствии с уравнением: С2Н5ОН + НАД+ + АДГ = СН3С(=О)Н + НАДН + Н+ + АДГ
Если этот процесс осуществить в электрохимической ячейке, то возможны следующие реакции на электродах:
(1) НАД+ + Н+ + 2е ![]() НАДН Е'0 (1) = -
0,32 В
НАДН Е'0 (1) = -
0,32 В
(2) СН3С(=О)Н + 2Н+ + 2е ![]() С2Н5ОН Е'0 (2) = -
0,20 В, где
С2Н5ОН Е'0 (2) = -
0,20 В, где
Е'0 (1) и Е'0 (2) - стандартные электродные потенциалы при рН = 7 и 298 К.
1) Записать схему электрохимической цепи, в которой протекает данная реакция.
2) Написать уравнение Нернста для расчета ЭДС этой цепи.
3) Рассчитать константу равновесия при рН = 7.
4) Рассчитать ![]() rG0 и
Е0 для этой цепи, если при выборе
стандартных состояний использована шкала
моляльных концентраций (1 моль/кг).
rG0 и
Е0 для этой цепи, если при выборе
стандартных состояний использована шкала
моляльных концентраций (1 моль/кг).
7. Константа равновесия реакции Н2 (г) + J2 (г) = 2HJ (г) при температуре Т равна 50. Будет ли происходить образование HJ (г) при температуре Т и следующих начальных концентрациях реагентов С (моль/л), если газы считать идеальными?
| N | С (Н2) | С (J2) | С (HJ) |
| 1 | 0,5 | 0,25 | 5 |
| 2 | 1 | 2 | 10 |
Решение варианта 17
1.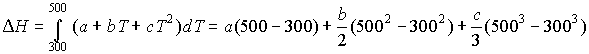
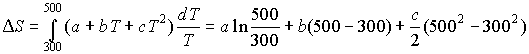
2. Экспериментально определяют теплоту
сгорания при постоянном объеме QV, причем QV = ![]() U .
U .
Реакция: С12Н22О11 (тв)+ 12О2 = 12СО2 + 11Н2О (ж)
Для этой реакции ![]() U
U ![]()
![]() Н .
Н . ![]()
![]() сН0 -
энтальпия сгорания 1 моля вещества,
следовательно
сН0 -
энтальпия сгорания 1 моля вещества,
следовательно ![]() сН0 = (4 ккал/г)?
М (г/моль), где М - молярная масса сахара.
сН0 = (4 ккал/г)?
М (г/моль), где М - молярная масса сахара.
3. U = ![]() + TS - PV
+ TS - PV
4. Опытная энергия активации при низких температурах положительна, а при высоких температурах отрицательна. В случае ферментативных реакций увеличение температуры может приводить к денатурации фермента и, следовательно, к уменьшению эффективной константы скорости реакции.
5. Если считать, что соль полностью
диссоциирована, то ![]() = 2cRT,
следовательно с =
= 2cRT,
следовательно с = ![]() /2RT, причем
с - в моль/л.
/2RT, причем
с - в моль/л.
6. 1) Pt | СН3С(=О)Н, Н+, С2Н5ОН || НАД+, Н+, НАДН | Pt
2) 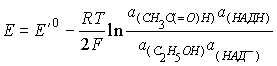 ,
где E'0 = Е'0 (1) - Е'0 (2)
,
где E'0 = Е'0 (1) - Е'0 (2)
3) ln Ka = nFE'0/RT
4) ![]() при 298 К. Рассчитав Е0, можно рассчитать
при 298 К. Рассчитав Е0, можно рассчитать ![]() rG0 :
rG0 : ![]() rG0 = - nFE0 = -
2FE0.
rG0 = - nFE0 = -
2FE0.
7. Применяем уравнение изотермы химической реакции:
![]() rGР,Т =
rGР,Т = ![]() rG0Т + RT ln
rG0Т + RT ln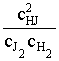 и
и ![]() rG0Т = -
RT ln KP. Для этой реакции КP = КC.
rG0Т = -
RT ln KP. Для этой реакции КP = КC.
1) ![]() rGР,Т = RT (ln 52/0,5.0,25 -
ln 50) = RT (ln 200 - ln 50) >
0, следовательно, образование HJ не пойдет.
rGР,Т = RT (ln 52/0,5.0,25 -
ln 50) = RT (ln 200 - ln 50) >
0, следовательно, образование HJ не пойдет.
2) ![]() rGР,Т = RT
(ln 102/2? 1 - ln 50) = RT (ln 50 -
ln 50) = 0, следовательно система
находится в равновесии и образование HJ не пойдет.
rGР,Т = RT
(ln 102/2? 1 - ln 50) = RT (ln 50 -
ln 50) = 0, следовательно система
находится в равновесии и образование HJ не пойдет.