Раздел 10. ВАРИАНТЫ ЗАДАНИЙ ПИСЬМЕННОГО ЗАЧЕТА
Вариант 1
1. Запишите условия равновесия в системе лед - жидкая вода.
2. В системе при постоянном объеме измерены экспериментальные зависимости внутренней энергии от температуры U - U0 = f(T) и давления от температуры P = f(T) соответственно. Как из этих данных найти (dU/dP)V?
3. Для необратимой химической реакции n А ![]() В получены кинетические кривые
при одинаковой начальной концентрации вещества
А при трех температурах (Т1 < Т2 <
Т3). Изобразите кинетические кривые для
исходного вещества при трех температурах. Как, не
определяя порядок этой реакции, определить ее
энергию активации?
В получены кинетические кривые
при одинаковой начальной концентрации вещества
А при трех температурах (Т1 < Т2 <
Т3). Изобразите кинетические кривые для
исходного вещества при трех температурах. Как, не
определяя порядок этой реакции, определить ее
энергию активации?
4. Энергия Гиббса реакции АТФ4- + Н2О = АДФ3- + Н+ + НРО42-
при температуре Т и физиологическом значении рН
(= 7) равна - 30 кДж/моль. Как рассчитать ![]() rG0Т для этой
реакции, если в качестве стандартного состояния
выбрана единичная концентрация, выраженная в
моль/л? Запишите выражение для константы
равновесия этой реакции.
rG0Т для этой
реакции, если в качестве стандартного состояния
выбрана единичная концентрация, выраженная в
моль/л? Запишите выражение для константы
равновесия этой реакции.
5. Запишите схему электрохимической цепи, с помощью которой можно определить концентрацию кислорода в живых тканях. Запишите реакцию в электрохимической цепи и уравнение Нернста для этой цепи. Как с помощью термодинамических функций рассчитать стандартное значение ЭДС этой цепи?
6. Запишите уравнение, связывающее концентрацию растворенного вещества в жидком идеальном растворе и осмотическое давление. Запишите уравнение, связывающее концентрацию газа в идеальном газообразном растворе и его парциальное давление. Можно ли на основании сходства этих уравнений сделать вывод о близости физических свойств жидких идеальных растворов и смесей идеальных газов?
7. В таблице приведены энтальпии образования (в кДж/моль) при 298 К для участников реакции: С6Н12О6 (тв) = 2С2Н5ОН (ж) + 2СО2 (г).
| С6Н12О6 (тв) | С2Н5ОН (ж) | СО2 (г) |
| - 1274.65 | - 276.98 | - 393.51 |
Как изменится константа равновесия этой реакции а) при увеличении температуры, б) при увеличении давления ? Ответ обосновать.
Вариант 2
1. В области температур от 298 до 1000 К теплоемкость вещества А описывается следующим уравнением: СP = а + bT + cT2, где а, b и с постоянные. Рассчитать изменение энтальпии и энтропии вещества при нагревании от 300 до 500 К.
2. Калорийность сахара равна 4 ккал/г. Как экспериментально определить эту величину? Как она связана со стандартной энтальпией сгорания сахара?
3. Напишите недостающие члены в уравнении
U = ![]() +....?....
+....?....
4. Константа скорости реакции следующим образом зависит от температуры (см. рис.). Какие выводы можно сделать об опытной энергии активации этой реакции? Можно ли эти выводы распространить на реакцию, протекающую с заметной скоростью только в присутствии фермента?
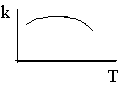
5. Осмотическое давление крови человека равно 7,7 атм при "нормальной" температуре. Рассчитать концентрацию изотонического (имеющего такое же осмотическое давление) раствора хлорида натрия.
6. Фермент алкогольдегидрогеназа (АДГ) катализирует окисление этилового спирта до ацетальдегида в соответствии с уравнением: С2Н5ОН + НАД+ + АДГ = СН3С(=О)Н + НАДН + Н+ + АДГ
Если этот процесс осуществить в электрохимической ячейке, то возможны следующие реакции на электродах:
| (1) НАД+ + Н+ + 2е |
Е'0 (1) = - 0.32 В |
| (2) СН3С(=О)Н + 2Н+ + 2е |
Е'0 (2) = - 0.20 В, |
где Е'0 (1) и Е'0 (2) - стандартные электродные потенциалы при рН = 7 и 298 К.
1) Записать схему электрохимической цепи, в которой может протекать данная реакция.
2) Написать уравнение Нернста для расчета ЭДС этой цепи.
3) Рассчитать константу равновесия при рН = 7.
4) Рассчитать ![]() rG0 и
Е0 для этой цепи, если при выборе
стандартных состояний использована шкала
моляльных концентраций (1 моль/кг).
rG0 и
Е0 для этой цепи, если при выборе
стандартных состояний использована шкала
моляльных концентраций (1 моль/кг).
7. Константа равновесия реакции Н2 (г) + J2 (г) = 2HJ (г) при температуре Т равна 50. Будет ли происходить образование HJ (г) при температуре Т и следующих начальных концентрациях реагентов С (моль/л), если газы считать идеальными?
| N | С (Н2) | С (J2) | С (HJ) |
| 1 | 0.5 | 0.25 | 5 |
| 2 | 1 | 2 | 10 |
Вариант 3
1. При использовании первого и второго закона термодинамики выведите формулу для зависимости энергии Гиббса вещества от давления при постоянной температуре. Примените полученную формулу для абсолютно твердого кристалла.
2. По аналогии с энтальпией образования на практике иногда используется термин "энергия Гиббса образования". Предложите способ расчета энергии Гиббса образования сахара из справочных данные по энтальпиям сгорания и энтропиям чистых веществ.
3. Вам известны стандартные энтальпии
образования и энтропии двух кристаллических
модификаций вещества А' и A" при температуре T.
Предложите способ оценки давления, при котором
эти модификации вещества будет сосуществовать
при данной температуре. Плотности модификаций ![]() ' и
' и ![]() "
соответственно.
"
соответственно.
4. Обоснуйте, как можно использовать результаты эксперимента по измерению осмотического давления для определения активности.
5. Докажите, что степень диссоциации газа AB будет увеличиваться при увеличении температуры при постоянном давлении.
6. ЭДС элемента Вестона, в котором протекает
реакция: Cd (тв) + Hg2SO4 (тв) = CdSO4 (р-
р) + 2Hg (ж), при температуре T1 равна E1.
Предложите способ расчета ЭДС при другой
температуре T2, если известна энтальпия
реакции ![]() rH0, которую
можно считать постоянной в данном интервале
температур.
rH0, которую
можно считать постоянной в данном интервале
температур.
7. Экспериментально измерено время полупревращения для некоторой реакции при нескольких температурах. При каких дополнительных условиях непосредственно из этих данных можно определить опытную энергию активации реакции?
Вариант 4
1. Для одного моля некоторого газа получена
зависимость объема от температуры и давления: V = k1T
+ b, V = ![]() + b, где k1, k2
- постоянные (соответственно при постоянных Р или
Т), b - индивидуальная константа газа. Допуская
существование функциональной связи между
объемом, давлением и температурой: V = f(T,Р) и
наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
+ b, где k1, k2
- постоянные (соответственно при постоянных Р или
Т), b - индивидуальная константа газа. Допуская
существование функциональной связи между
объемом, давлением и температурой: V = f(T,Р) и
наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
2. Покажите, что изотерма и адиабата идеального газа для равновесного процесса, проведенные на плоскости, могут пересекаться только в одной точке.
3. Напишите выражение для константы равновесия КP приведенной реакции: CrCl2 (тв) + H2 (г) = Cr (тв) + 2 HCl (г),
обозначив через х число молей прореагировавшего Н2, а через Р общее равновесное давление. В начальный момент исходные вещества взяты в стехиометрическом отношении, а продукты отсутствуют. Все газообразные соединения - идеальные газы.
4. Определите в общем виде изменение энергии
Гиббса ![]() G0268 при
кристаллизации 1 г переохлажденной до 268 К
воды, если известны удельные теплоемкости воды и
льда, а также удельная энтальпия кристаллизации
воды при 273 К. Какой знак и почему будет иметь
G0268 при
кристаллизации 1 г переохлажденной до 268 К
воды, если известны удельные теплоемкости воды и
льда, а также удельная энтальпия кристаллизации
воды при 273 К. Какой знак и почему будет иметь ![]() G0 в этом процессе?
G0 в этом процессе?
5. Почему при одинаковой концентрации
растворенного нелетучего вещества понижение
температуры плавления растворителя оказывается
большим по сравнению с увеличением температуры
его кипения: ![]() ТПЛ >
ТПЛ > ![]() ТКИП ?
ТКИП ?
6. Напишите реакции, протекающие на электродах в гальваническом элементе, схема которого приведена ниже, а также суммарное уравнение процесса.
Pt | H2 | HCl (водный р- р) | Cl2 (г) | Pt
Принимая во внимание связь ЭДС с изменением энергии Гиббса, определите, как изменится его ЭДС с увеличением внешнего давления.
7. Для некоторой необратимой химической
реакции получена температурная зависимость
времени превращения реагента на 25% от исходной
концентрации: ![]() 1/4 = f(T). Как
по этим данным можно определить энергию
активации реакции? Какие условия проведения
эксперимента необходимо соблюдать?
1/4 = f(T). Как
по этим данным можно определить энергию
активации реакции? Какие условия проведения
эксперимента необходимо соблюдать?
Вариант 5
1. Для одного моля некоторого газа известны значения частных производных внутренней энергии и энтропии по объему при постоянной температуре: (dU/dV)T = a/V, (dS/dV)Т = R/(V- b), a, b - индивидуальные постоянные газа. Используя уравнение Максвелла, установите уравнение состояния этого газа.
2. Получите выражение для разности теплоемкостей СP - СV для любой системы и, в частном случае, для идеального газа.
3. Почему твердый углекислый газ при обычных условиях испаряется, а лед плавится?
4. Зависимость давления насыщенного пара (идеальный газ) над некоторой жидкостью от температуры выражается уравнением:
ln Р (атм) = A - B/T - C ln T + DT (A, B, C, D - положительные
постоянные величины). Известна стандартная
мольная энтропия жидкости ![]() (ж) при температуре TХ < TН.Т.К..
Как, используя эти данные, можно рассчитать
стандартную мольную энтропию пара при
температуре TХ:
(ж) при температуре TХ < TН.Т.К..
Как, используя эти данные, можно рассчитать
стандартную мольную энтропию пара при
температуре TХ: ![]() (пар)
(пар)
(Р = 1 атм)?
5. Показать, что для идеальных растворов двух
летучих жидкостей А и В суммарное давление пара:
Р = РА + РВ = ![]() +
xB(
+
xB(![]() -
- ![]() ), где
), где ![]() и
и ![]() - давления пара над
чистыми жидкостями, xB - мольная доля
вещества В.
- давления пара над
чистыми жидкостями, xB - мольная доля
вещества В.
6. Для определения рН некоторого раствора в горных условиях при 298 К применяется электрохимическая ячейка, включающая водородный электрод и стандартный каломельный электрод. С ее помощью на равнине (Р (Н2) = 1 атм) установлено некоторое значение рН. Принимая во внимание, что давление водорода изменяется с высотой в соответствии с барометрической формулой: Р = Р0exp (- Mgh/RT), где M - молекулярная масса газа, h - высота, Р0 - давление газа на уровне h = 0, g - ускорение свободного падения, выведите формулу для расчета рН на произвольной высоте h.
7. Необратимая реакция имеет целочисленный
порядок в интервале от одного до трех. Отношение
времен превращения на кратную часть ![]() 1/2:
1/2: ![]() 3/4 = 0.2, где
3/4 = 0.2, где
![]() 1/2 и
1/2 и ![]() 3/4
время превращения реагента на 50% и 75%
соответственно. Чему равен порядок этой реакции?
3/4
время превращения реагента на 50% и 75%
соответственно. Чему равен порядок этой реакции?
Вариант 6
1. Предложите способ определения стандартной энтальпии образования глицина (тв).
2. Водород, взятый в количестве n молей при
температуре Т1, нагревается при постоянном
давлении Р = 1атм до температуры Т2. Найдите ![]() Н,
Н, ![]() S и
S и ![]() G в этом процессе, считая водород
идеальным газом. Нужны ли дополнительные
справочные данные для решения этой задачи?
G в этом процессе, считая водород
идеальным газом. Нужны ли дополнительные
справочные данные для решения этой задачи?
3. Зависимость давления насыщенного пара перфторорганического соединения, использующегося в качестве компонента искусственной крови, от температуры имеет вид: lg Р= а - b/Т - с lg T (Т, К; Р, Па), где а, b, с - постоянные. Найдите зависимость энтальпии и энтропии испарения этого соединения от температуры.
4. Стандартная энтальпия реакции гидрирования бензола при Т=298 К С6Н6 (г) + 3Н2 (г) = С6Н12 (г) равна 651.5 кДж/моль. Как объяснить, что промышленный синтез циклогексана проводят при высоких температуре и общем давлении в системе. Газы считать идеальными.
5. В бинарном жидком растворе давление над чистым вторым компонентом равно Р02. Известно, что в области малых концентраций этого вещества (при мольной доле х2 < 0.05) зависимость его давления от х2 описывается законом Генри с константой К2. Найдите отношение коэффициентов активности второго компонента в симметричной и несимметричной системах сравнения при х2 = 0.5. Изменится ли эта величина при изменении х2?
6. Предложите гальванический элемент, где протекает реакция
AgBr (тв) + 0.5Н2 (г) = Ag (тв) + НВr (водный р- р). Напишите реакции, протекающие на электродах. Как определить Е0 этого гальванического элемента.
7. Найдите отношение времен превращения исходного вещества на половину и на одну четвертую часть в реакции 2-го порядка.