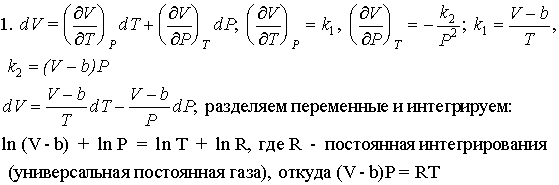
Решение варианта 4
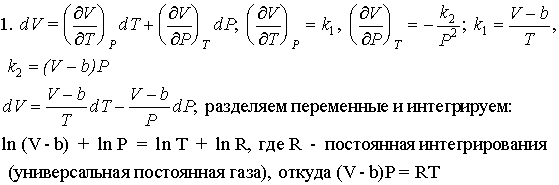
2.Изотерма идеального газа PV = const, адиабата идеального газа
PV![]() = const,
= const, ![]() = Cp/Cv
> 1, поэтому совпадение кривых возможно только в
одной точке.
= Cp/Cv
> 1, поэтому совпадение кривых возможно только в
одной точке.
3.
CrCl2 (тв) |
+ H2 (г) | = Cr (тв) + | 2 HCl (г) |
число молей при равновесии: |
1- x |
2x |
сумма молей ![]() n = 1+x; KP =
n = 1+x; KP = 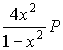
4. Расчет изменения энтальпии и энтропии проводим по равновесным стадиям нагрева переохлажденной воды до 273 К, кристаллизации и охлаждения льда до 268 К при условии постоянства теплоемкостей:
![]() Н0268 = СР,Ж
(273- 268) +
Н0268 = СР,Ж
(273- 268) + ![]() Н0273 + СР,ТВ
(268- 273) =
Н0273 + СР,ТВ
(268- 273) = ![]() Н0273 +
Н0273 +
+ (СР,Ж - СР,ТВ) ![]() Т
Т
![]() S0268 = CP,Ж
S0268 = CP,Ж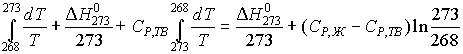
![]() G0268
=
G0268
= ![]() H0268 - 268.
H0268 - 268. ![]() S0268<0 - процесс
самопроизвольный.
S0268<0 - процесс
самопроизвольный.
5. 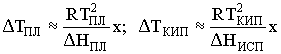 , где х - мольная
доля растворенного вещества.
, где х - мольная
доля растворенного вещества. ![]() НПЛ
НПЛ
![]()
![]() НИСП, что приводит к
НИСП, что приводит к ![]() ТПЛ >
ТПЛ > ![]() ТИСП,
несмотря на то, что ТКИП > ТПЛ.
ТИСП,
несмотря на то, что ТКИП > ТПЛ.
6.
| Н2 - 2е |
| Cl2 + 2е |
| H2 (г) + Cl2 (г) |
D G = - nFE; 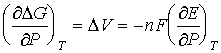 ;
; ![]() V < 0, ЭДС возрастает с
увеличением давления.
V < 0, ЭДС возрастает с
увеличением давления.
7. 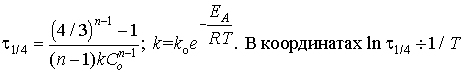 получаем прямую
линию, из тангенса угла наклона которой находим
энергию активации ЕА. Необходимые условия:
закрытая система, постоянство начальной
концентрации C0 и порядка реакции n при
разных температурах, независимость k0 от
температуры.
получаем прямую
линию, из тангенса угла наклона которой находим
энергию активации ЕА. Необходимые условия:
закрытая система, постоянство начальной
концентрации C0 и порядка реакции n при
разных температурах, независимость k0 от
температуры.