Раздел 3. Второй и третий законы термодинамики. Энтропия.
1. Приведите различные формулировки и математические выражения второго закона (начала) термодинамики в дифференциальной и интегральной формах.
2. Приведите различные формулировки и математические выражения третьего закона термодинамики.
3. Напишите математическое соотношение между изменением энтропии системы и переданной теплотой в случаях бесконечно малого и конечного изменения величин.
4. Система переходит из состояния 1 в
состояние 2 двумя путями: обратимым (поглощает
теплоту Qобр) и необратимым (поглощает
теплоту Qнеобр). Каково соотношение между Qобр
и Qнеобр? Каково соотношение между ![]() Sобр и
Sобр и ![]() Sнеобр?
Sнеобр?
5. Пользуясь представлениями первого и второго начал термодинамики, покажите, что в случае пересечения проведенных на плоскости равновесных изотермы и адиабаты в 2-х точках будет нарушен постулат Томсона.
6. Обоснуйте на примере статистический характер второго закона термодинамики.
7. Используя уравнение Больцмана рассчитать число микросостояний и энтропию кристалла NaF (0.1 моля) при 0 К, если а) кристалл идеален и не содержит примесей, б) кристалл содержит 1 атом К и один атом Cl, замещающие атомы натрия и фтора в его структуре.
8. Почему на практике не используется термин "энтропия образования"? Если ввести такой термин по аналогии с энтальпией образования, то какой знак будет иметь энтропия образования а) сахара? б ) молекулярного кислорода?
9. Используя изменение энтропии в качестве характеристики протекания процесса в адиабатически изолированных системах, покажите, что свободное расширение газа в пустоту (против нулевого внешнего давления) от объема V1 до объема V2 является необратимым процессом.
10. В сосуде при 25 0С и давлении 1 атм
находится 5.74 г газа азота. Записать уравнения,
применяя которые можно рассчитать ![]() Т,
Т, ![]() U и
U и ![]() S, при обратимом
адиабатическом расширении газа до объема 6 л.
Укажите выбранную Вами модель.
S, при обратимом
адиабатическом расширении газа до объема 6 л.
Укажите выбранную Вами модель.
11. В области температур от 298 до 1000 К теплоемкость вещества А описывается следующим уравнением: СP = а + bT + cT2, где а, b и с постоянные для вещества А. Рассчитать изменение энтальпии и энтропии вещества при нагревании от 300 до 500 К.
12. Рассчитайте температуру смеси и изменение энтропии в процессе смешения 3 кг воды при 353 К с 6 кг воды, взятой при 290 К. Принять, что теплоемкость воды СР равна 75.3 Дж/моль.К и не зависит от температуры.
13. 1 г льда, взятого при 273 К, прибавлен к 10 г воды. взятой при температуре 373 К. Какова конечная температура смеси и чему равно изменение энтропии в этом процессе? Энтальпия плавления льда равна 80 кал/г, СР воды равна 1 кал/г.К.
14. Энтальпия плавления льда при 273 К равна 1436 кал/моль, СР льда и жидкой воды составляют 8.9 и 18.0 кал/моль.К соответственно. Рассчитайте изменение энтропии в неравновесном процессе затвердевания воды при 263 К.
15. Вычислите изменение энтропии при плавлении трех молей переохлажденного бензола при 270 К, если при 278.65 К его энтальпия плавления равна 2379.5 кал/моль; СР(ж) = 30.4 кал/моль.К, СР(тв) = 29.5 кал/моль.К, а давление постоянно и равно 1 атм.
16. В области температур от 0 до 12 К
теплоемкость серебра хорошо описывается по
"закону кубов" Дебая СV = ![]() Т3, причем
известно экспериментальное значение
теплоемкости серебра при 12 К СP (12 К).
Как рассчитать изменение энтальпии и энтропии
серебра при нагревании от 0 до 12 К. Можно ли
рассчитать Н (12 К) и S (12 К) для серебра?
Т3, причем
известно экспериментальное значение
теплоемкости серебра при 12 К СP (12 К).
Как рассчитать изменение энтальпии и энтропии
серебра при нагревании от 0 до 12 К. Можно ли
рассчитать Н (12 К) и S (12 К) для серебра?
17. Почему при расчете энтальпии и энтропии реакции из справочных данных используются разные подходы?
![]() rH =
rH = ![]() j
j ![]() f Hj (прод) -
f Hj (прод) - ![]() i
i ![]() f Hi (исх)
f Hi (исх)
![]() rS =
rS = ![]() jSj (прод) -
jSj (прод) - ![]() iSi(исх)
iSi(исх)
18. Выведите формулу для пересчета ![]() rS от температуры T1
до T2 при постоянном давлении (аналог
уравнения Кирхгофа).
rS от температуры T1
до T2 при постоянном давлении (аналог
уравнения Кирхгофа).
19. Используя выражение
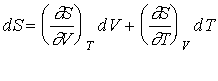
выведите уравнение адиабаты для идеального
газа в форме ТV![]() -1 = k,
где k постоянная, а
-1 = k,
где k постоянная, а ![]() = СР/СV.
= СР/СV.
20. В случае идеального газа покажите, что ![]() S (V,P) = nCР lnV2/V1 + nCV lnP2/P1 .
S (V,P) = nCР lnV2/V1 + nCV lnP2/P1 .
21. Реакция 2Н2 + О2 = 2Н2О (ж)
протекает самопроизвольно при 298 К, но расчет
показывает, что ![]() rS0 (298) = -370 Дж/моль.К.
Противоречит ли полученный результат второму
закону термодинамики? Ответ обосновать.
rS0 (298) = -370 Дж/моль.К.
Противоречит ли полученный результат второму
закону термодинамики? Ответ обосновать.
22. Энтальпия равновесного перехода серы
ромбической (SP) в моноклинную (SМ) при
Т1 и 1 атм равна ![]() Н1
Дж/моль. Как найти изменение энтропии в
неравновесном процессе перехода SP
Н1
Дж/моль. Как найти изменение энтропии в
неравновесном процессе перехода SP ![]() SМ при Т2 < T1,
если СP (SP) = a + bT, СP (SМ) = a* + b*T
(Дж/моль.К), а, а*, b, b*- постоянные?
SМ при Т2 < T1,
если СP (SP) = a + bT, СP (SМ) = a* + b*T
(Дж/моль.К), а, а*, b, b*- постоянные?
23. С 1 молем идеального газа реализован обратимый цикл, приведенный на рисунке (1-2 - адиабата, 2-3 -изотерма, 3-1-изобара). Изобразите указанный цикл в координатах S, T. Теоретически обоснуйте свое решение.
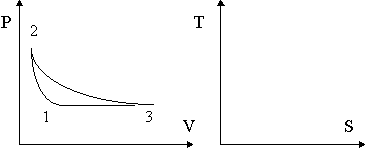
24. С 1 молем идеального газа реализован обратимый цикл, приведенный на рисунке (2-3 - адиабата). Изобразите указанный цикл в координатах S, T. Теоретически обоснуйте свое решение.
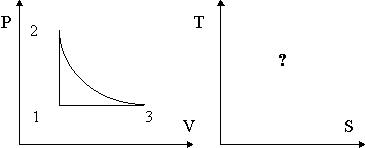
25. С 1 молем идеального газа реализован обратимый цикл, приведенный на рисунке (2-3 - изотерма). Изобразите указанный цикл в координатах S, T. Теоретически обоснуйте свое решение.
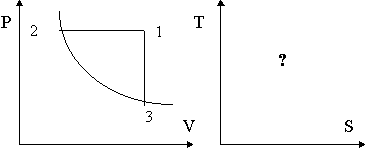
26. Криптон, n молей которого занимают объем V1 при температуре Т1, изохорно нагрели до температуры Т2, затем изобарно охладили и сжали до температуры Т3 и объема V3 и вернули в исходное состояние путем изотермического расширения до объема V1. Изобразите цикл в координатах V-T и S-T и найдите изменение энтропии на всех участках цикла и за полный цикл.
27. Изобразите цикл Карно для 1 моля идеального газа в координатах P, V и S, T. Теоретически обоснуйте свое решение.
28. Изобразите цикл Карно в координатах Р= f (V), U= f (S).
29. Изобразите цикл Карно в координатах Р= f (V), H= f (S).
Раздел 4. Математический аппарат термодинамики.
1. Получите выражение для разности теплоемкостей СP - СV для любой системы и, в частном случае, для идеального газа.
2. Для некоторого идеального газа известны значения удельных теплоемкостей СP и СV. Как по этим данным рассчитать его молекулярную массу?
3. Покажите, что для одного моля газа, подчиняющегося уравнению состояния р(V-b)=RT, СP - СV =R.
4. При использовании фундаментального уравнения Гиббса и соотношения Максвелла показать, что теплоемкость СV идеального газа не зависит от объема системы.
5. Напишите недостающие члены в уравнении
U = ![]() +....?....
+....?....
6. Исходя из определения энтальпии и обобщенного уравнения первого и второго закона термодинамики выведите уравнения для дифференциала dH. Запишите соответствующее уравнение Максвелла.
7. Для какой системы энергия Гиббса будет являться критерием равновесия?
8. Показать, что энергия Гиббса является характеристической функцией, если она задана в виде функции от естественных переменных.
9. Показать, что энергия Гельмгольца является характеристической функцией, если она задана в виде функции от естественных переменных.
10. На примере любой характеристической функции опишите ее свойства.
11. Приведите пример термодинамического потенциала.
12. В случае реального газа внутренняя энергия является функцией объема и температуры. Запишите полный дифференциал U . Выразите соответствующие частные производные через экспериментально измеряемые величины.
13. В случае реального газа энтальпия является функцией давления и температуры. Запишите полный дифференциал Н . Выразите соответствующие частные производные через экспериментально измеряемые величины.
14. Система находится при постоянной температуре и объеме. Какую термодинамическую функцию следует выбрать в качестве критерия равновесия для этой системы?
15. Как оценить, сколько максимальной полезной работы, необходимой для поддержания жизни, можно получить при полном окислении двух молей глюкозы при 25 0С?
16. Как изменится внутренняя энергия газа при увеличении объема системы в три раза в изотермических условиях, если газ а) идеальный, б) подчиняется уравнению Ван-дер-Ваальса?
17. Как изменятся энтропия и энергия Гельмгольца газа при уменьшении объема системы в два раза в изотермических условиях, если газ а) идеальный, б) подчиняется уравнению Ван-дер-Ваальса?
18. Газ, занимающий объем V1, расширяется в пустоту до объема 2V1 в термически изолированном сосуде (адиабатический процесс). Как изменится внутренняя энергия газа и его температура, если газ подчиняется уравнению Ван-дер-Ваальса?
19. Показать, что для 1 моля газа
Ван-дер-Ваальса 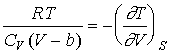
20. При использовании первого и второго закона термодинамики выведите формулу для зависимости энтропии вещества от объема при постоянной температуре. Примените полученную формулу для идеального газа.
21. При использовании первого и второго закона термодинамики выведите формулу для зависимости энтропии вещества от давления при постоянной температуре. Примените полученную формулу для идеального газа.
22. При использовании первого и второго закона термодинамики выведите формулу для зависимости энтальпии вещества от давления при постоянной температуре. Примените полученную формулу для абсолютно твердого кристалла.
23. При использовании первого и второго закона термодинамики выведите формулу для зависимости энергии Гельмгольца вещества от давления при постоянной температуре. Примените полученную формулу для идеального газа.
24. При использовании первого и второго закона термодинамики выведите формулу для зависимости энергии Гиббса вещества от давления при постоянной температуре. Примените полученную формулу для абсолютно твердого кристалла.
25. По аналогии с энтальпией образования на практике иногда используется термин "энергия Гиббса образования". Предложите способ расчета энергии Гиббса образования сахара из справочных данные по энтальпиям сгорания и энтропиям чистых веществ.
26. Для одного моля некоторого газа известны значения частных производных внутренней энергии и энтропии по объему при постоянной температуре: (dU/dV)T = 0, (dS/dV)Т = R/V. Используя уравнение Максвелла, установите уравнение состояния этого газа.
27. Для одного моля некоторого газа известны значения частных производных внутренней энергии и энтропии по объему при постоянной температуре: (dU/dV)T = 0, (dS/dV)Т = R/(V- b), b - индивидуальная постоянная газа. Используя уравнение Максвелла, установите уравнение состояния этого газа.
28. Для одного моля некоторого газа известны значения частных производных внутренней энергии и энтропии по объему при постоянной температуре: (dU/dV)T = a/V2, (dS/dV)Т = R/(V- b), a, b - индивидуальные постоянные газа. Используя уравнение Максвелла, установите уравнение состояния этого газа.
29. Для одного моля некоторого газа известны значения частных производных внутренней энергии и энтропии по объему при постоянной температуре: (dU/dV)T = a/V, (dS/dV)Т = R/(V- b), a, b - индивидуальные постоянные газа. Используя уравнение Максвелла, установите уравнение состояния этого газа.
30. Неидеальный газ подчиняется уравнению состояния P(V - nb) = nRT. Докажите, что для этого газа (dU/dV)T = 0.
31. Для одного моля газа Ван-дер-Ваальса, имеющего уравнение состояния
(Р + a/V2)(V - b) = RT, используя уравнения Максвелла выразите производную (dU/dV)T через термодинамические параметры состояния и постоянные уравнения.
32. Для одного моля газа Ван-дер-Ваальса, имеющего уравнение состояния
(Р + a/V2)(V - b) = RT, используя уравнения Максвелла найдите изменение энтропии при изотермическом обратимом расширении от объема V1 до объема V2.
33. Энергия Гиббса 1 моля некоторого газа описывается зависимостью G = U0 + CPT(1 - ln T) - TS0 + RTln P, где U0, S0, CP - постоянные.
Найти уравнение состояния этого газа.
34. Энергия Гельмгольца 1 моля некоторого газа описывается зависимостью F = U0 - TS0 + CVT(1 - lnT) - a/ (TV) - RTln(V - b), где U0, S0, CV , a, b - постоянные. Найти уравнение состояния этого газа.
35. Энергия Гельмгольца 1 моля некоторого газа описывается зависимостью F = U0 - TS0 + CVT(1 - lnT) - a/V - RTln(V - b), где U0, S0, CV , a, b - постоянные. Найти уравнение состояния этого газа.
36. Энергия Гельмгольца 1 моля некоторого газа описывается зависимостью F = U0 - TS0 + CVT(1 - lnT) - RTln V, где U0, S0, CV - постоянные. Найти уравнение состояния этого газа.
37. Определите в общем виде изменение энергии
Гиббса ![]() G0268
при кристаллизации 1 г переохлажденной до
268 К воды, если известны удельные теплоемкости
воды и льда, а также удельная энтальпия
кристаллизации воды при 273 К. Какой знак и
почему будет иметь
G0268
при кристаллизации 1 г переохлажденной до
268 К воды, если известны удельные теплоемкости
воды и льда, а также удельная энтальпия
кристаллизации воды при 273 К. Какой знак и
почему будет иметь ![]() G0
в этом процессе?
G0
в этом процессе?
38. Какой знак будет иметь величина ![]() G0 для процессов:
G0 для процессов:
Н2О (ж) при t = - 50 С ![]() Н2О (тв) при t = - 50 С
Н2О (тв) при t = - 50 С
Н2О (ж) при t = 00 С ![]() Н2О (тв) при t = 00 С
Н2О (тв) при t = 00 С
Н2О (ж) при t = 50 С ![]() Н2О (тв) при t = 50 С
Н2О (тв) при t = 50 С
Ответ обосновать.
39. При 268.2 К давление насыщенного пара твердого бензола равно 2279.8 Па, а над переохлажденным жидким бензолом 2639.7 Па. Вычислите изменение энергии Гиббса в процессе плавления 2 молей переохлажденного бензола. Пары бензола считать идеальным газом.
40. Найдите изменение энергии Гиббса при нагревании 1 моля СО2 от 298.15 до 350 К при Р = 1 атм, если СР = 37.1 Дж/моль.К и не зависит от температуры, а стандартная энтропия углекислого газа при 298 К равна 213.68 Дж/моль.К. Газ считать идеальным.
41. Каково соотношение между энергией Гиббса и энергией Гельмгольца некоторой системы? Какова связь между изменением энергии Гиббса и энергии Гельмгольца в химической реакции?
42. Докажите, что (d![]() rG/dT)p
= -
rG/dT)p
= - ![]() rS
rS
43. Найдите ![]() F и
F и ![]() G при одновременном
сжатии от давления Р1 до давления Р2 и
нагревании от температуры Т1 до
температуры Т2 n молей одноатомного
идеального газа. Нужны ли дополнительные
справочные данные для решения этой задачи?
G при одновременном
сжатии от давления Р1 до давления Р2 и
нагревании от температуры Т1 до
температуры Т2 n молей одноатомного
идеального газа. Нужны ли дополнительные
справочные данные для решения этой задачи?
44. Приведите примеры химических реакций с
участием веществ природного происхождения , для
которых при постоянной температуре ![]() F =
F = ![]() G,
G, ![]() F <
F < ![]() G и
G и ![]() F >
F > ![]() G. Газы
считать идеальными, изменением объема
конденсированных фаз пренебречь.
G. Газы
считать идеальными, изменением объема
конденсированных фаз пренебречь.
45. Водород, взятый в количестве n молей при
температуре Т1, нагревается при постоянном
давлении Р = 1атм до температуры Т2. Найдите ![]() Н,
Н, ![]() S и
S и ![]() G в этом
процессе, считая водород идеальным газом. Нужны
ли дополнительные справочные данные для решения
этой задачи?
G в этом
процессе, считая водород идеальным газом. Нужны
ли дополнительные справочные данные для решения
этой задачи?
46. Этиловый спирт, взятый в количестве n
молей, испарили при нормальной температуре
кипения Т1 и увеличили объем пара до V2
при Т1. Найдите ![]() U,
U, ![]() H,
H, ![]() S,
S, ![]() F и
F и ![]() G в этом процессе, если
энтальпия испарения спирта при Т1 равна
G в этом процессе, если
энтальпия испарения спирта при Т1 равна ![]() VH кДж/моль. Принять,
что пары спирта являются идеальным газом.
VH кДж/моль. Принять,
что пары спирта являются идеальным газом.
47. Аргон, взятый в количестве n молей при
давлении Р1 и температуре Т1, изобарно
нагрет до температуры Т2, затем
изотермически сжат до давления Р3 и
возвращен в исходное состояние путем изохорного
охлаждения до температуры Т1. Найдите ![]() U,
U, ![]() H,
H, ![]() S и
S и ![]() F на всех участках цикла и за полный
цикл, газ считать идеальным, стандартная
энтропия аргона при Т1 равна S01.
F на всех участках цикла и за полный
цикл, газ считать идеальным, стандартная
энтропия аргона при Т1 равна S01.
48. В сосуде объемом 5 л при 25 0С и
давлении 1 атм находится газ азот. При обратимом
адиабатическом расширении газа его температура
снизилась на 20 0С. Записать уравнения,
применяя которые можно рассчитать ![]() Н и
Н и ![]() G этого
процесса, если при 25 0С S0 (N2)
= 45.77 э.е. Указать выбранную Вами модель.
G этого
процесса, если при 25 0С S0 (N2)
= 45.77 э.е. Указать выбранную Вами модель.
49. Рассчитать изменение энергии Гиббса при увеличении давления от двух до трех атм для двух молей а) жидкой воды, б) газообразной воды. Укажите выбранную Вами модель.
50. В сосуде при 25 0С и давлении 1 атм
находится газ азот. Записать уравнения, применяя
которые можно рассчитать работу, ![]() Т,
Т, ![]() S и
S и ![]() F при обратимом
адиабатическом расширении газа от объема 5 л
до объема 6 л, если при 25 0С S0 (N2)
= 45.77 э.е. Укажите выбранную Вами модель.
F при обратимом
адиабатическом расширении газа от объема 5 л
до объема 6 л, если при 25 0С S0 (N2)
= 45.77 э.е. Укажите выбранную Вами модель.
51. Найдите ![]() U,
U, ![]() H,
H, ![]() S,
S, ![]() F и
F и ![]() G при обратимом адиабатическом
сжатии n молей кислорода, взятого при температуре
Т1 и давлении Р1 = 1 до давления Р2.
Газ считать идеальным. Нужны ли дополнительные
справочные данные для решения этой задачи?
G при обратимом адиабатическом
сжатии n молей кислорода, взятого при температуре
Т1 и давлении Р1 = 1 до давления Р2.
Газ считать идеальным. Нужны ли дополнительные
справочные данные для решения этой задачи?
52. Найдите изменение внутренней энергии, энтальпии, энтропии, энергии Гиббса и энергии Гельмгольца при расширении 3 молей кислорода от объема 100 л до 500 л при 298 К.
53. Четыре моля идеального одноатомного газа
расширяются изотермически при 27 0С от
начального объема V1 до конечного объема V2.
Процесс А: против постоянного внешнего
давления Р. Процесс В: равновесно. Записать
уравнения, применяя которые можно рассчитать
теплоту, работу, ![]() U,
U, ![]() S и
S и ![]() G для каждого из процессов.
G для каждого из процессов.
54. Найдите ![]() U,
U, ![]() H,
H, ![]() S,
S, ![]() F и
F и ![]() G в процессе смешения V1 м3
аргона и V2 м3 криптона при
температуре Т и давлении P, (газы идеальные).
Зависят ли указанные характеристики этого
процесса от температуры?
G в процессе смешения V1 м3
аргона и V2 м3 криптона при
температуре Т и давлении P, (газы идеальные).
Зависят ли указанные характеристики этого
процесса от температуры?
55. Найдите изменение внутренней энергии, энтальпии, энтропии, энергии Гельмгольца и энергии Гиббса для процесса смешения 2 л кислорода с 3 л азота при 273.15 К. Газы считать идеальными, а давление постоянным.
56. Три моля идеального одноатомного газа
расширяются изотермически при 27 0С от
начального объема V1 до конечного объема V2.
Процесс А: в вакуум. Процесс В: равновесно.
Записать уравнения, применяя которые можно
рассчитать теплоту, работу, ![]() U,
U, ![]() Н,
Н, ![]() S,
S, ![]() G,
G, ![]() F для каждого из процессов.
F для каждого из процессов.
57. Запишите одну из форм уравнения Гиббса-Гельмгольца, если система совершает электрическую работу.
58. Используя определение приведенной
энергии Гиббса: F ' = - (G0 - H0 298)/T,
выведите связь ![]() rG0
с
rG0
с ![]() rH0298
и
rH0298
и ![]() rF '.
rF '.
59. Используя определение приведенной
энергии Гиббса
F = - (G0 - H00)/T, покажите, что ![]() rФ =
rФ = ![]() rS0 - (
rS0 - (![]() rH0 -
rH0 - ![]() rH00)/T.
rH00)/T.
60. Покажите, что 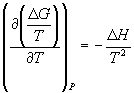 .
Используя это уравнение, выведите уравнение
изобары Вант-Гоффа.
.
Используя это уравнение, выведите уравнение
изобары Вант-Гоффа.