Раздел 1. Основные термодинамические понятия и определения. Уравнения состояния. Первый закон термодинамики.
1. Приведите определение уравнения состояния.
2. Запишите вириальное уравнение состояния реального газа.
3. Для одного моля некоторого газа получена зависимость объема от температуры и давления: V = k 1T, V = k2 /Р, где k1, k2 - постоянные (соответственно при постоянных Р или Т). Допуская существование функциональной связи между объемом, давлением и температурой: V = f (T,Р) и наличие полного дифференциала этой функции, найдите уравнение состояния данного газа.
4. Для одного моля некоторого газа получена
зависимость объема от температуры и давления: V = k1T
+ b, V = ![]() + b, где k1, k2
- постоянные (соответственно при постоянных Р или
Т), b - индивидуальная константа газа. Допуская
существование функциональной связи между
объемом, давлением и температурой: V = f (T,Р) и
наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
+ b, где k1, k2
- постоянные (соответственно при постоянных Р или
Т), b - индивидуальная константа газа. Допуская
существование функциональной связи между
объемом, давлением и температурой: V = f (T,Р) и
наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
5. Для одного моля некоторого газа получена
зависимость объема от температуры и давления: V = k1T
+ b, V = ![]() + b, где k1, k2
- постоянные (соответственно при постоянных Р или
Т), a, b - индивидуальные константы газа. Допуская
существование функциональной связи между
объемом, давлением и температурой V = f (T,Р)
и наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
+ b, где k1, k2
- постоянные (соответственно при постоянных Р или
Т), a, b - индивидуальные константы газа. Допуская
существование функциональной связи между
объемом, давлением и температурой V = f (T,Р)
и наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
6. Для одного моля некоторого газа получена
зависимость объема от температуры и давления: V = k1T+
(A-В), V = ![]() + (A-B), где k1,
k2 - постоянные (соответственно при
постоянных Р или Т), A, B - индивидуальные константы
газа. Допуская существование функциональной
связи между объемом, давлением и температурой
V = f (T,Р) и наличие полного дифференциала
этой функции, найдите уравнение состояния
данного газа.
+ (A-B), где k1,
k2 - постоянные (соответственно при
постоянных Р или Т), A, B - индивидуальные константы
газа. Допуская существование функциональной
связи между объемом, давлением и температурой
V = f (T,Р) и наличие полного дифференциала
этой функции, найдите уравнение состояния
данного газа.
7. Для одного моля некоторого газа получена зависимость объема от температуры и давления: V = k1T1/2, V = k2/p1/2, где k1, k2 - постоянные (соответственно при постоянных Р или Т). Допуская существование функциональной связи между объемом, давлением и температурой V = f (T,Р) и наличие полного дифференциала этой функции, найдите уравнение состояния данного газа.
8. Для одного моля некоторого газа получена зависимость давления от температуры и объема: Р = k1T, Р = k2(1/V + B/V2), где k1, k2 - постоянные (соответственно при постоянных V или Т), B - индивидуальная константа газа. Допуская существование функциональной связи между объемом, давлением и температурой Р = f (T,V) и наличие полного дифференциала этой функции, найдите уравнение состояния данного газа.
9. Покажите на примере идеального газа и газа Ван-дер-Ваальса, что d 2р/dVdT = d2р/dTdV.
10. Докажите справедливость следующего соотношения:
![]()
11. Напишите уравнение первого закона (начала) термодинамики в дифференциальной форме. Проинтегрируйте его и получите выражение для конечного изменения системы. Ответ обоснуйте.
12. Приведите формулировки и математические выражения первого закона термодинамики в интегральной и дифференциальной формах.
13. Приведите примеры интенсивных и экстенсивных термодинамических параметров, которые входят в выражения для теплоты и любого вида работы.
14. Покажите, что изотерма и адиабата идеального газа для равновесного процесса, проведенные на плоскости, могут пересекаться только в одной точке.
15. Цикл Майера состоит из следующих стадий: один моль идеального газа с начальным давлением Р1 и объемом V1 адиабатически расширяют в пустоту до объема V2. Затем его обратимо сжимают до объема V1 при постоянном давлении Р2. Наконец, газ обратимо нагревается при постоянном объеме V1 до тех пор, пока его давление не станет равным Р1. Рассчитав изменение внутренней энергии на каждой стадии цикла, докажите соотношение Майера для идеального газа: СP - СV = R.
16. В системе при постоянном объеме измерены экспериментальные зависимости внутренней энергии от температуры U - U0 = f(T) и давления от температуры P = f (T) соответственно. Как из этих данных найти (dU/dP)V?
17. Заполнить таблицу для обратимых процессов, изображенных на рисунке, с участием 2-х молей одноатомного газа.
| Процесс | Характер процесса |
Q | A | ||
| 1 |
|||||
| 2 |
|||||
| 3 |
|||||
| S |
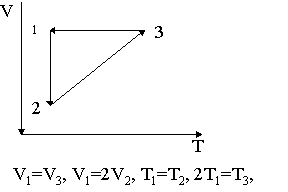
Изобразить цикл в координатах P = f (V).
18. Записать уравнения, применяя которые
можно рассчитать теплоту, работу, ![]() U,
U, ![]() Н при
обратимом изотермическом расширении трех молей
аргона, если объем увеличивается в четыре раза,
температура 30 0С. Укажите выбранную Вами
модель.
Н при
обратимом изотермическом расширении трех молей
аргона, если объем увеличивается в четыре раза,
температура 30 0С. Укажите выбранную Вами
модель.
19. Газ, занимающий объем V1, расширяется адиабатически в вакуум до объема 2V1. Как изменится внутренняя энергия газа и его температура, если газ идеальный?
20. При обратимом изобарном нагревании объемы 1 моля одноатомного газа и 1 моля двухатомного газа увеличились на одну и ту же величину. Для какого из этих газов изменение энтальпии будет наибольшим?
21. Два газа - одноатомный и двухатомный - расширяются адиабатически и обратимо. Для какого из этих газов работа расширения будет больше, если число молей обоих газов одинаково, а температура в первом и втором случаях понизилась на одну и ту же величину?
22. В изолированной системе протекает реакция сгорания водорода в кислороде. Изменится ли общая внутренняя энергия и энтальпия системы?
23. Что в конце концов произойдет с любым живым организмом, если поместить его в изолированную термодинамическую систему?
Раздел 2. Термохимия.
1. Согласно первому закону термодинамики теплота не есть функция состояния. Что значит в законе Гесса утверждение, что тепловой эффект реакции не зависит от пути процесса?
2. При каких условиях теплота химической
реакции Q равна а) ![]() rН, б)
rН, б) ![]() rU ?
rU ?
3. Каким процессам соответствует стандартная энтальпия образования и стандартная энтальпия сгорания молочной кислоты? Запишите соответствующие уравнения реакций.
4. Докажите на основе закона Гесса, что ![]() rH =
rH = ![]() i
i ![]() cHi (исх) -
cHi (исх) - ![]() j
j![]() c Hj
(прод). Можно на примере конкретной реакции.
c Hj
(прод). Можно на примере конкретной реакции.
5. Стандартная энтальпия образования сульфата лития при 298 К равна
- 1216 кДж/моль. Какому процессу соответствует данная численная величина? Запишите соответствующую реакцию. Поглощается или выделяется при этом энергия?
6. Калорийность сахара равна 4 ккал/г. Как экспериментально определить эту величину? Как она связана со стандартной энтальпией сгорания сахара?
7. Рассчитать, сколько тепла выделится при полном окислении 1 т метана, полученного из биомассы, экологически чистого "топлива", в результате жизнедеятельности анаэробных бактерий. Укажите какие данные необходимы для проведения этого расчета.
8. Энтальпии образования двух органических изомеров A' и A" равны - 10 и 10 кДж/моль соответственно. При сгорании какого из изомеров выделится наибольшее количество тепла? Ответ обоснуйте.
9. Энтальпии образования двух органических изомеров B' и B" равны - 15 и 15 кДж/моль соответственно. Какой изомер будет иметь большую энергию диссоциации на атомы? Ответ обоснуйте.
10. Предложите способ определения стандартной энтальпии образования фруктозы (тв.).
11. Предложите способ определения стандартной энтальпии образования глицина (тв.).
12. Предложите способ определения стандартной энтальпии образования аланина (тв.).
13. В закрытой системе протекает химическая реакция между газообразными веществами так, что не совершается никакой другой работы, кроме механической. Вам необходимо получить соотношение между тепловыми эффектами при постоянном объеме и при постоянном давлении QP - QV. Что следует учесть при выводе этого соотношения, если газы неидеальные?
14. Дайте определение понятию "тепловой эффект химической реакции". Для реакции: 2 Ag(NO3) (тв) = 2 Ag (тв) + 2 NO2 (г) + O2 (г) при некоторой произвольной температуре Т получите соотношение между тепловым эффектом при постоянном давлении и тепловым эффектом при постоянном объеме.
15. Приведите примеры химических реакций, для
которых при постоянных температуре и давлении ![]() U <
U < ![]() H и
H и ![]() U=
U=![]() H. Укажите
выбранную Вами модель.
H. Укажите
выбранную Вами модель.
16. Приведите примеры химических реакций, для
которых при постоянных температуре и давлении ![]() U >
U > ![]() H и
H и ![]() U =
U = ![]() H.
Укажите выбранную Вами модель.
H.
Укажите выбранную Вами модель.
17. Энтальпия реакции С2Н4 (г) + Cl2 (г) = СН2С1СН2С1 (ж) при 335 К равна - 43.653 ккал/моль. Найдите энтальпию образования жидкого дихлорэтана при 298 К, если при 298 К энтальпия сгорания С2Н4 равна -337.184 ккал/моль, а энтальпии образования СО2 (г) и Н2О (ж) равны -94.052 и -68.315 ккал/моль соответственно. Принять, что изобарные теплоемкости веществ не зависят от температуры и равны: 10.26 кал/моль.К (С2Н4); 18.8 кал/моль.К (С2Н4С12) , 8.1 кал/моль.К (С12).
18. Стандартная энтальпия образования
жидкого гексана при 298 К равна ![]() fН0. Как рассчитать
fН0. Как рассчитать ![]() fН0 и
fН0 и ![]() fU0 для этого
углеводорода при 500С?
fU0 для этого
углеводорода при 500С?
19. Энтальпия растворения гидроксида натрия в
воде при бесконечном разбавлении при 250С
равна ![]() Н0. Как, используя
справочные значения стандартных энтальпий
образования ионов, рассчитать
Н0. Как, используя
справочные значения стандартных энтальпий
образования ионов, рассчитать ![]() fН0 (298К)
гидроксида натрия?
fН0 (298К)
гидроксида натрия?
20. Температурная зависимость энтальпии
образования сульфида ртути
выражается уравнением: ![]() fH0 = - 10393 - 4.627.T + 15.9.10-3.T2 - 18.49.10-6.T3.
Выведите
fH0 = - 10393 - 4.627.T + 15.9.10-3.T2 - 18.49.10-6.T3.
Выведите
уравнение зависимости изменения теплоемкости
в этой реакции ![]() fCP от
температуры.
fCP от
температуры.
21. Для реакции CH3OH (ж) + 1.5O2 = CO2 + 2H2O (ж)
зависимость
энтальпии от температуры выражается уравнением:
![]() rH = - 684710 + 36.77.T - 38.56.10-3.T2 + 8.21.10-6.T3 + 2.88.105/T.
rH = - 684710 + 36.77.T - 38.56.10-3.T2 + 8.21.10-6.T3 + 2.88.105/T.
Выведите уравнение зависимости изменения
теплоемкости в этой реакции ![]() rCР
от температуры.
rCР
от температуры.
22. Экспериментально были определены энтальпии следующих реакций:
1) СаО (тв) + 2НС1 (р-р) = СаС12 (р-р) + Н2О (р-р)
2) V2O5 (тв) + 2НС1 (р-р) + 3Н2О (р-р) = 2V(ОН)4С1 (р-р)
3) СаV2O6 (тв) + 4НС1 (р-р) + 2Н2О (р-р) = СаС12 (р-р) + 2V(OH)4CI (р-р)
4) 2V (тв) + 2.5O2 (г) = V2O5 (тв)
Энтальпию еще какой реакции необходимо знать, чтобы определить энтальпию образования СаV2O6 (тв)? Если все исходные данные известны, то как найти энтальпию образования СаV2O6 (тв.)?
23. Экспериментально были определены энтальпии следующих реакций:
1)МgV2O6 (тв) + 4НС1 (р-р) + 2Н2О (р-р) = МgCl2 (р-р) + 2V(OH)4Cl(р-р)
2) МgО (тв) + 2НС1 (р-р) = МgCl2 (р-р) + Н2О (р-р)
3) V2O5 (тв) + 2НС1 (р-р) + 3Н2О (р-р) = 2V(OH)4Cl (р-р)
4) Мg (тв) + 0.5O2 (г) = МgO (тв)
Энтальпию еще какой реакции необходимо знать, чтобы определить энтальпию образования МgV2O6(тв.)? Если все исходные данные известны, то как найти энтальпию образования МgV2O6(тв.)?
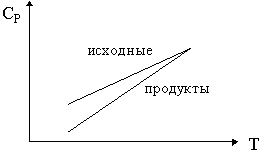
24. Изобразите зависимость теплового эффекта
реакции: ![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1' А1'
+
1' А1'
+ ![]() 2' А2 ' + ... от
температуры, если зависимости сумм
теплоемкостей исходных веществ (
2' А2 ' + ... от
температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi)
и продуктов (
iCPi)
и продуктов (![]()
![]() jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:
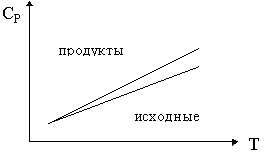
25. Изобразите зависимость теплового эффекта
реакции: ![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1' А1'
+
1' А1'
+ ![]() 2' А2 ' + ...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2' А2 ' + ...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi)
и продуктов (
iCPi)
и продуктов (![]()
![]() jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид:
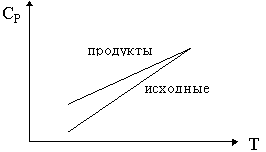
26. Изобразите зависимость теплового эффекта
реакции: ![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1' А1'
+
1' А1'
+ ![]() 2' А2 ' + ...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2' А2 ' + ...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi) и продуктов (
iCPi) и продуктов (![]()
![]() jCPj) от температуры
имеют вид:
jCPj) от температуры
имеют вид:
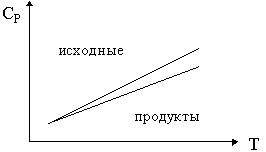
27. Изобразите зависимость теплового эффекта
реакции: ![]() 1А1 +
1А1 + ![]() 2А2 + ...
2А2 + ...
![]()
![]() 1' А1'
+
1' А1'
+ ![]() 2' А2 ' + ...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (
2' А2 ' + ...
от температуры, если зависимости сумм
теплоемкостей исходных веществ (![]()
![]() iCPi)
и продуктов (
iCPi)
и продуктов (![]()
![]() jCPj) от
температуры имеют вид:
jCPj) от
температуры имеют вид: